Похожие презентации:
Карбоциклические соединения. Циклоалканы
1.
Министерство науки и высшего образования РФ ФГБОУ ВО«Самарский государственный технический университет»
Химико-технологический факультет
Кафедра органической химии
Направление
подготовки
04.03.01 «Химия»
Органическая химия
Лекция № 10
Тема: Карбоциклические соединения. Циклоалканы.
Классификация и номенклатура. Способы получения.
Химические свойства.
Преподаватель: д.х.н., профессор Климочкин Ю.Н
2.
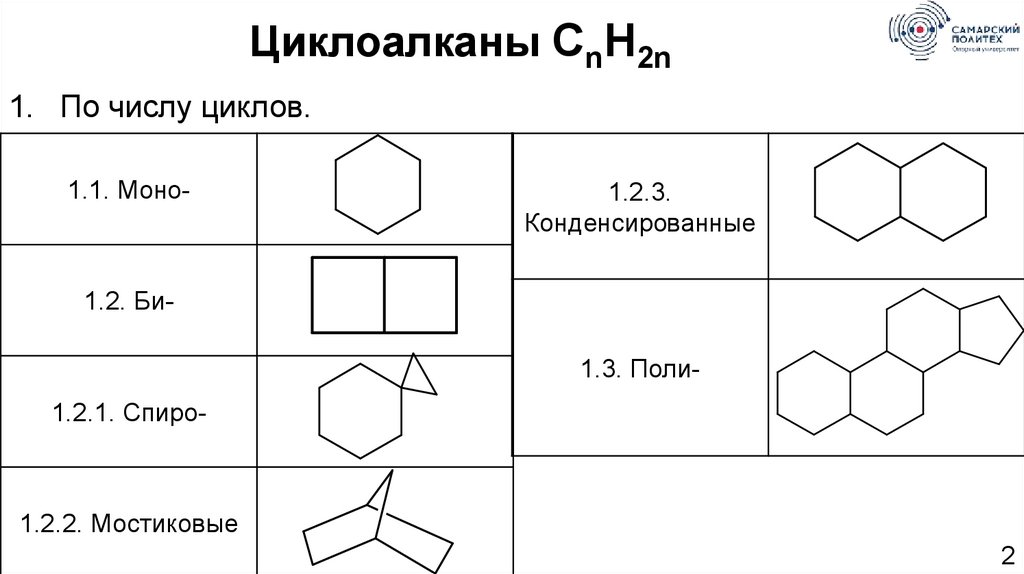
Циклоалканы CnH2n1. По числу циклов.
1.1. Моно-
1.2.3.
Конденсированные
1.2. Би1.3. Поли1.2.1. Спиро-
1.2.2. Мостиковые
2
3.
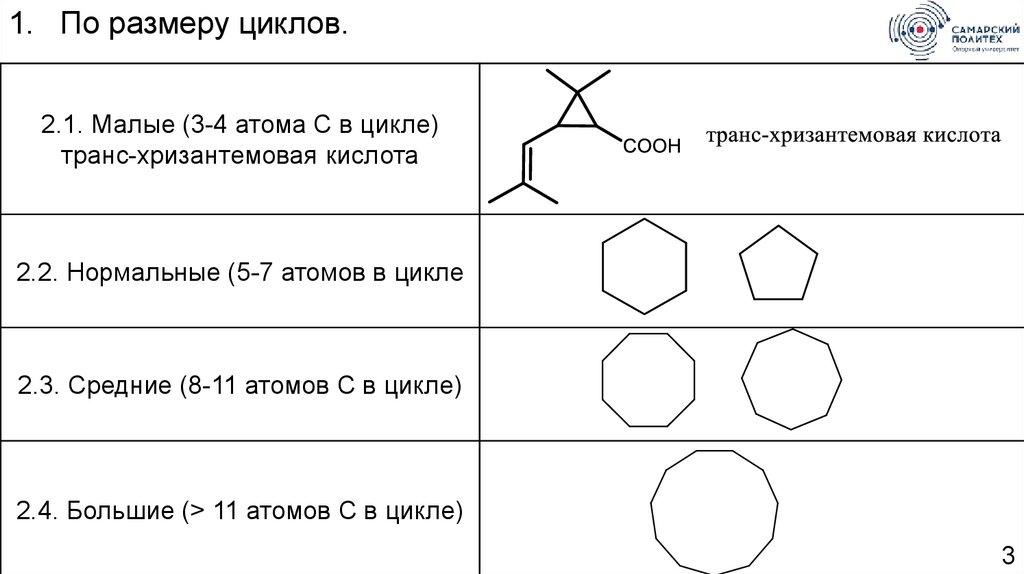
1. По размеру циклов.2.1. Малые (3-4 атома С в цикле)
транс-хризантемовая кислота
2.2. Нормальные (5-7 атомов в цикле
2.3. Средние (8-11 атомов С в цикле)
2.4. Большие (> 11 атомов С в цикле)
3
4.
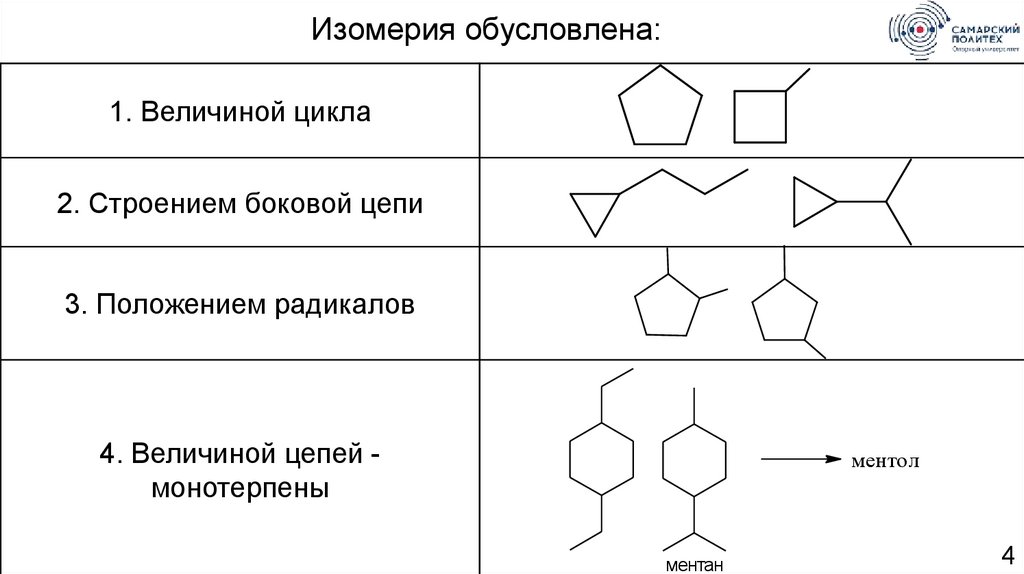
Изомерия обусловлена:1. Величиной цикла
2. Строением боковой цепи
3. Положением радикалов
4. Величиной цепей монотерпены
ментол
ментан
4
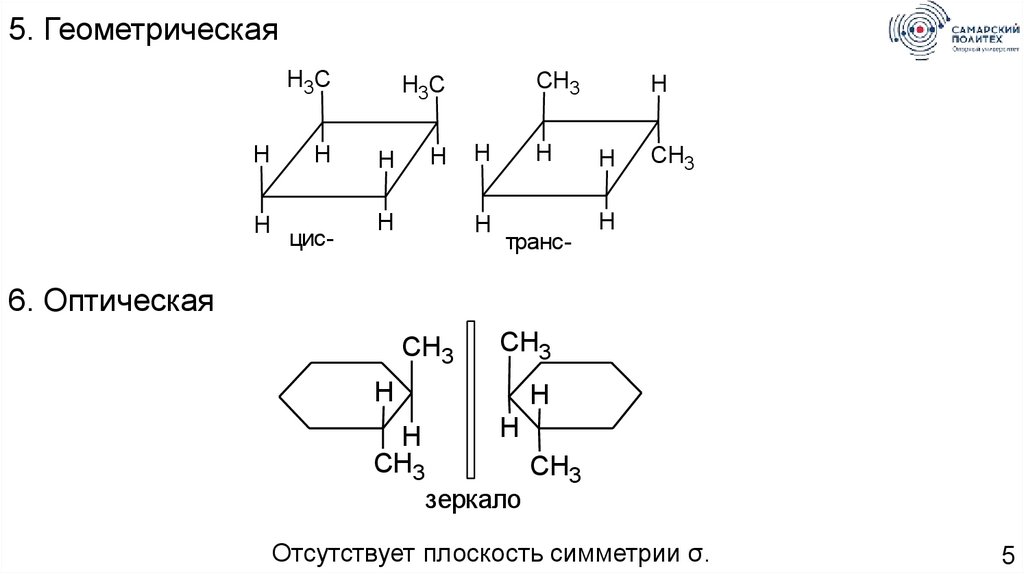
5.
5. ГеометрическаяH3C
CH3
H3C
H
H
H
H
цис-
H
H
H
H
H
транс-
H
H
CH3
H
6. Оптическая
CH3
CH3
H
H
CH3
H
H
зеркало
CH3
Отсутствует плоскость симметрии σ.
5
6.
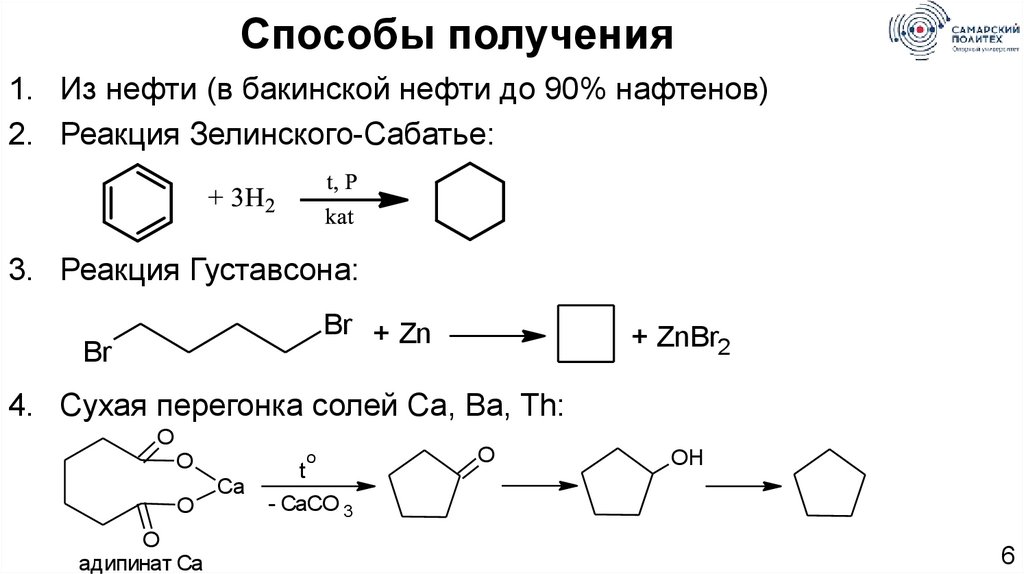
Способы получения1. Из нефти (в бакинской нефти до 90% нафтенов)
2. Реакция Зелинского-Сабатье:
3. Реакция Густавсона:
Br + Zn
Br
+ ZnBr2
4. Сухая перегонка солей Ca, Ba, Th:
O
O
O
O
адипинат Ca
Ca
t
o
O
OH
- CaCO 3
6
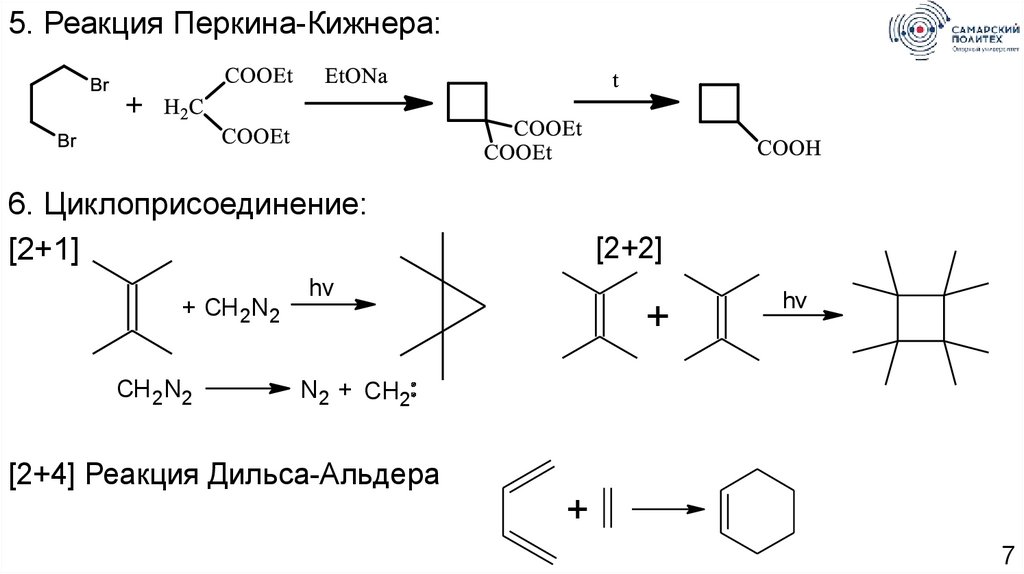
7.
5. Реакция Перкина-Кижнера:6. Циклоприсоединение:
[2+1]
+ CH 2N2
CH 2N2
[2+2]
hv
+
hv
N2 + CH2
[2+4] Реакция Дильса-Альдера
+
7
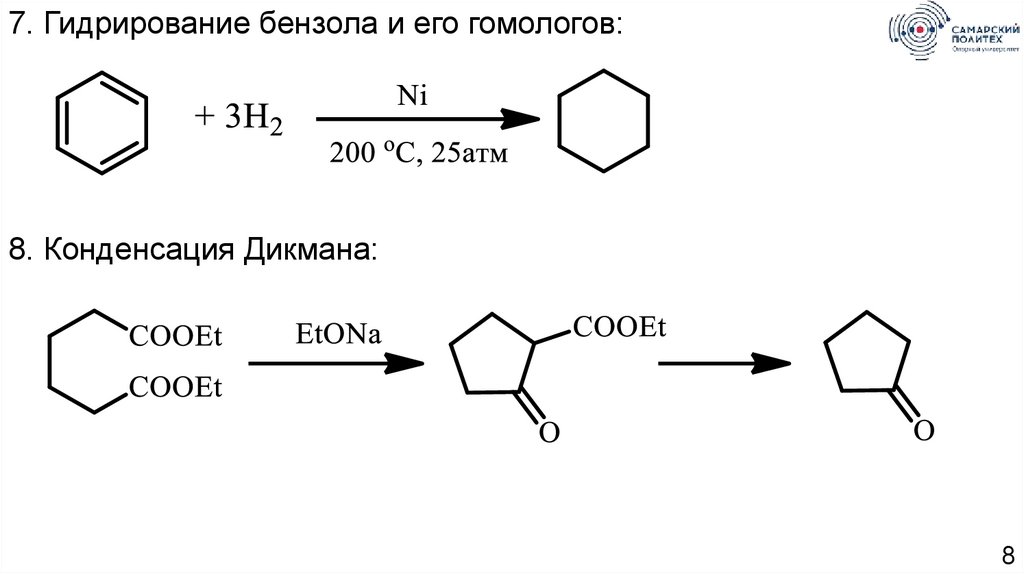
8.
7. Гидрирование бензола и его гомологов:8. Конденсация Дикмана:
8
9.
Прочность циклов. Теория напряжения.1. По теплоте сгорания
2. Напряжение Байера (угловое) – увеличение энергии
молекулы, вызванное отклонением угла между связями от
величины нормального тетраэдрического угла (109˚28’)
3. Напряжение Питцера (торсионное) - увеличение энергии
молекулы, вызванное отклонением конформации любого
этаноподобного звена в молекуле циклоалкана от
заторможенной.
4. Напряжение Прелога (трансаннулярное) - увеличение
энергии молекулы вследствие взаимодействия несвязанных
атомов и фрагментов (двойных связей, функциональных
групп и т. д.)
9
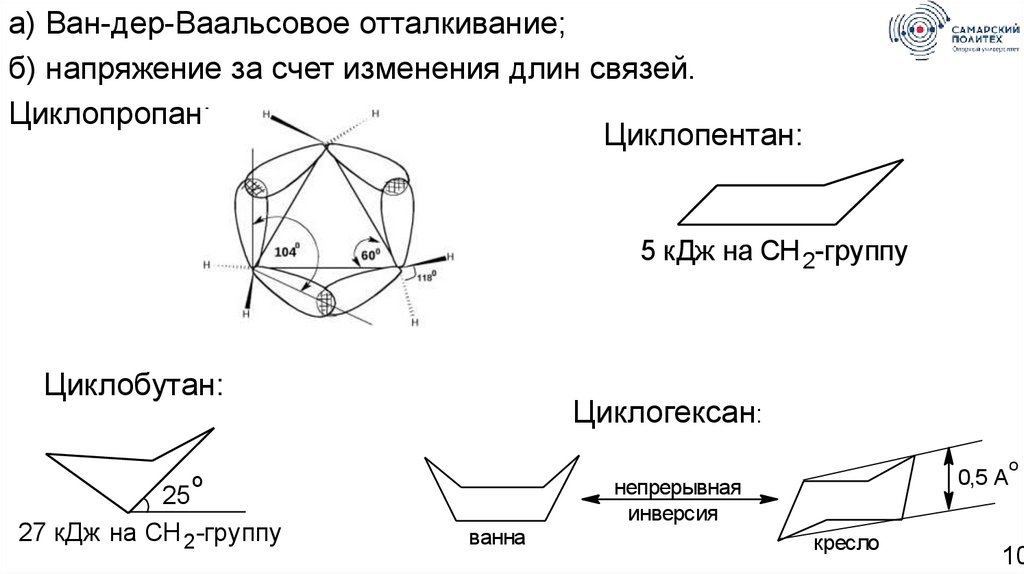
10.
а) Ван-дер-Ваальсовое отталкивание;б) напряжение за счет изменения длин связей.
Циклопропан:
Циклопентан:
5 кДж на CH 2-группу
Циклобутан:
Циклогексан:
o
25
27 кДж на CH 2-группу
0,5 A
непрерывная
инверсия
ванна
кресло
o
10
11.
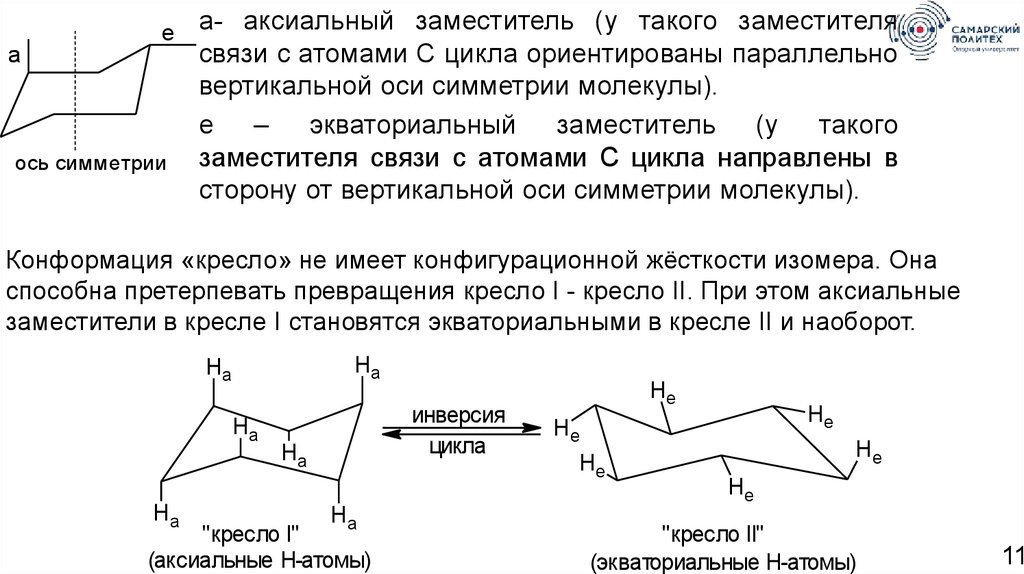
ea
ось симметрии
а- аксиальный заместитель (у такого заместителя
связи с атомами С цикла ориентированы параллельно
вертикальной оси симметрии молекулы).
е – экваториальный заместитель (у такого
заместителя связи с атомами С цикла направлены в
сторону от вертикальной оси симметрии молекулы).
Конформация «кресло» не имеет конфигурационной жёсткости изомера. Она
способна претерпевать превращения кресло I - кресло II. При этом аксиальные
заместители в кресле I становятся экваториальными в кресле II и наоборот.
Ha
Ha
Ha
Ha
инверсия
цикла
Ha
Ha
"кресло I"
(аксиальные Н-атомы)
He
He
He
He
He
He
"кресло II"
(экваториальные Н-атомы)
11
12.
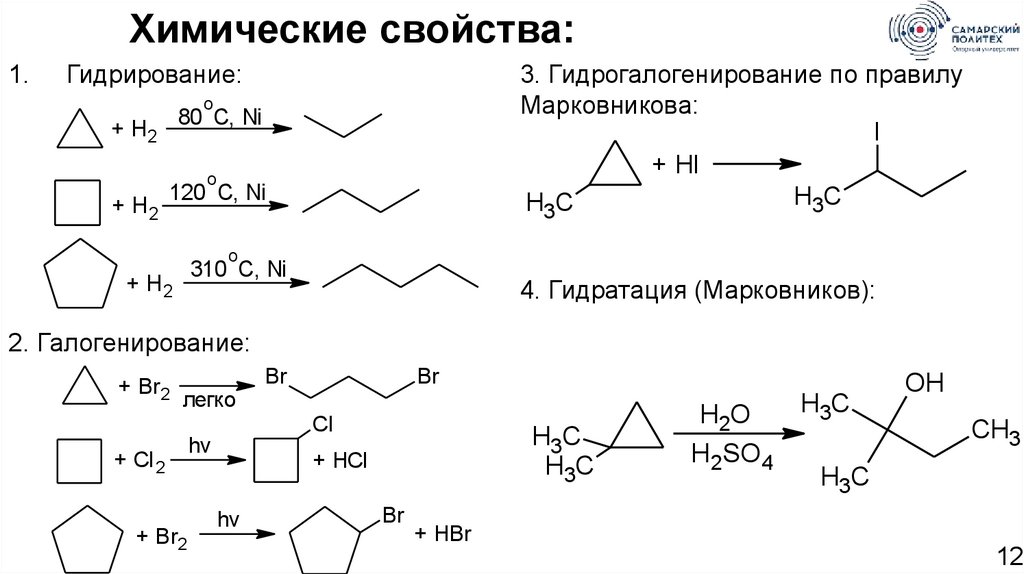
Химические свойства:1.
Гидрирование:
3. Гидрогалогенирование по правилу
Марковникова:
l
+ Hl
H3C
H3C
o
80 C, Ni
+ H2
o
+ H2
120 C, Ni
o
310 C, Ni
+ H2
4. Гидратация (Марковников):
2. Галогенирование:
+ Br2
легко
Br
Br
Cl
+ Cl 2
+ Br2
hv
H3C
H3C
+ HCl
hv
Br
H2O
H2SO4
H3C
OH
CH3
H3C
+ HBr
12
13.
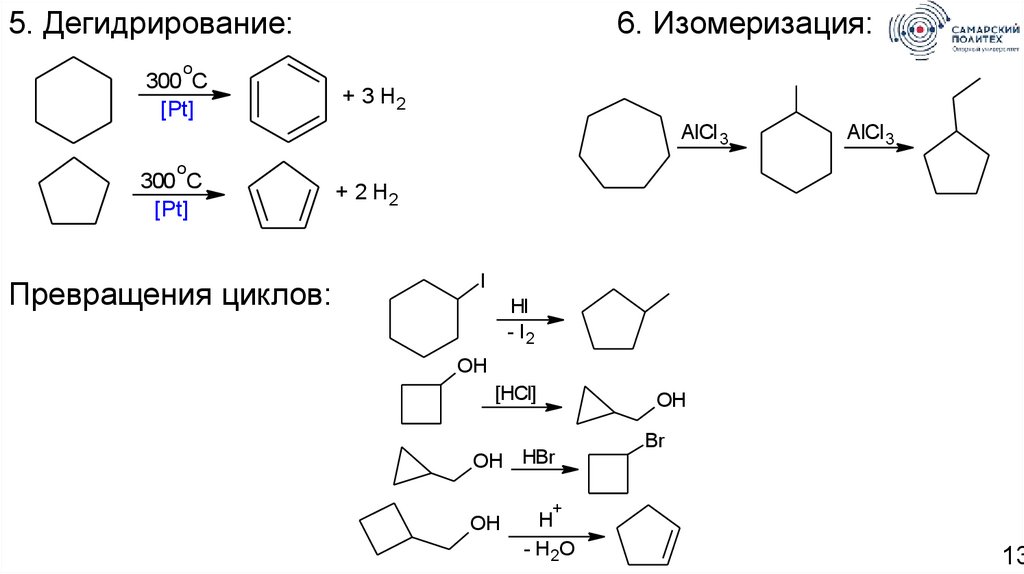
5. Дегидрирование:6. Изомеризация:
o
300 C
[Pt]
+ 3 H2
AlCl 3
AlCl 3
o
300 C
[Pt]
Превращения циклов:
+ 2 H2
I
HI
- I2
OH
[HCI]
OH
OH HBr
OH
Br
+
H
- H 2O
13
14.
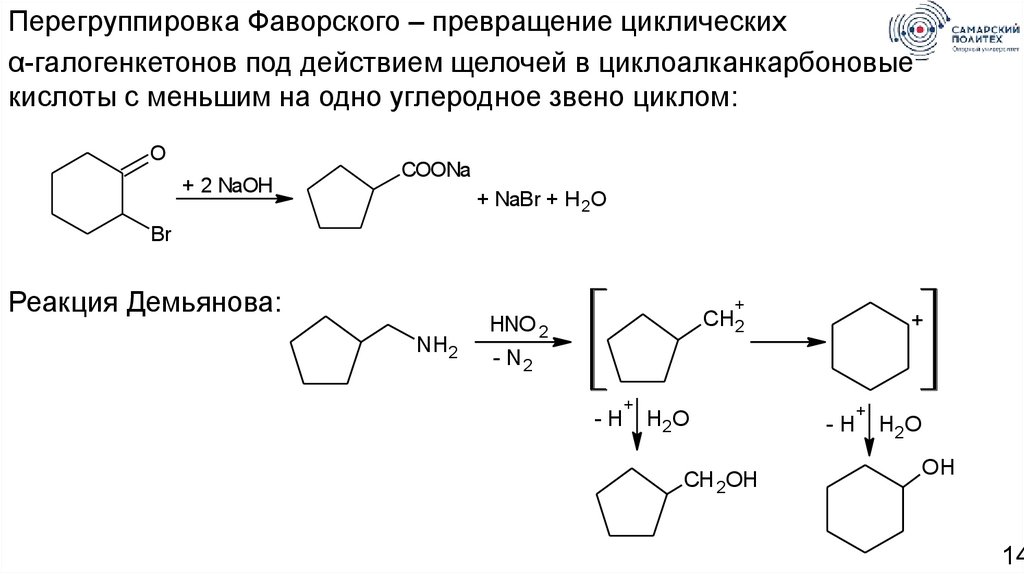
Перегруппировка Фаворского – превращение циклическихα-галогенкетонов под действием щелочей в циклоалканкарбоновые
кислоты с меньшим на одно углеродное звено циклом:
O
+ 2 NaOH
COONa
+ NaBr + H 2O
Br
Реакция Демьянова:
+
NH2
CH2
HNO 2
+
- N2
-H
+
H2O
CH 2OH
-H
+
H2O
OH
14
15.
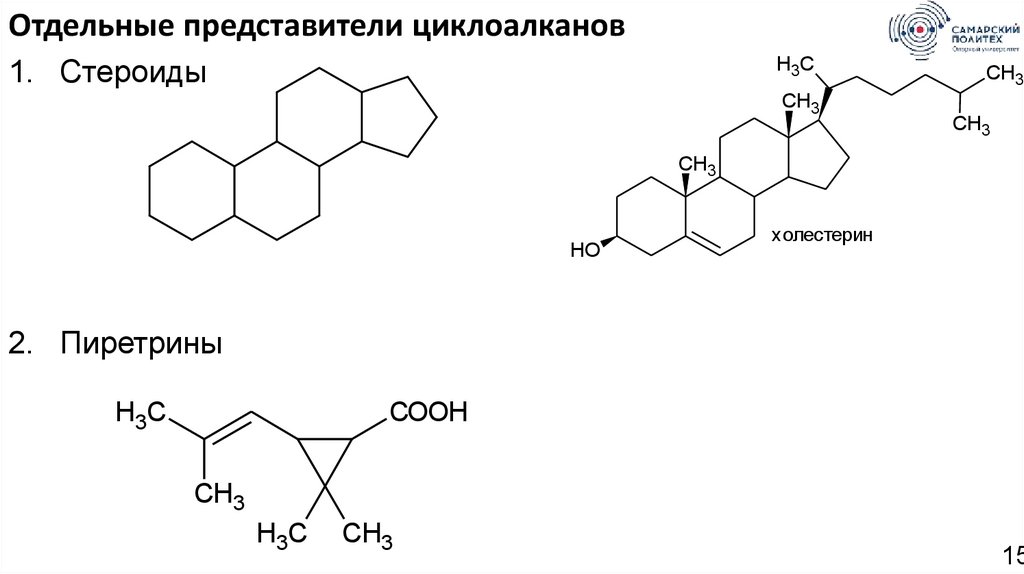
Отдельные представители циклоалканов1. Стероиды
H3C
CH3
CH3
CH3
CH3
HO
холестерин
2. Пиретрины
H3C
COOH
CH3
H3C
CH3
15
16.
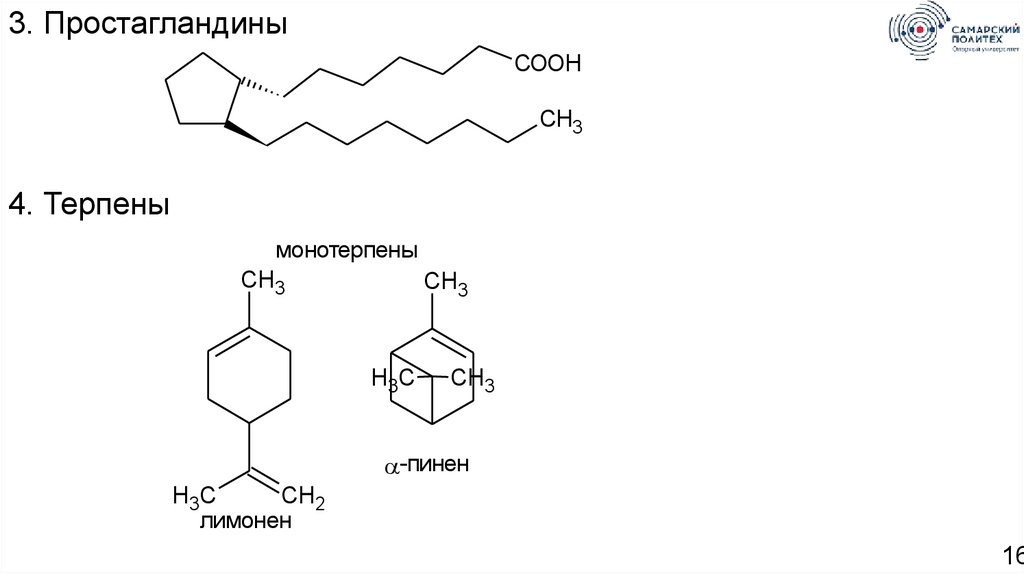
3. ПростагландиныCOOH
CH3
4. Терпены
монотерпены
CH3
CH3
H3C
CH3
-пинен
H3C
CH2
лимонен
16


 Химия
Химия








