Похожие презентации:
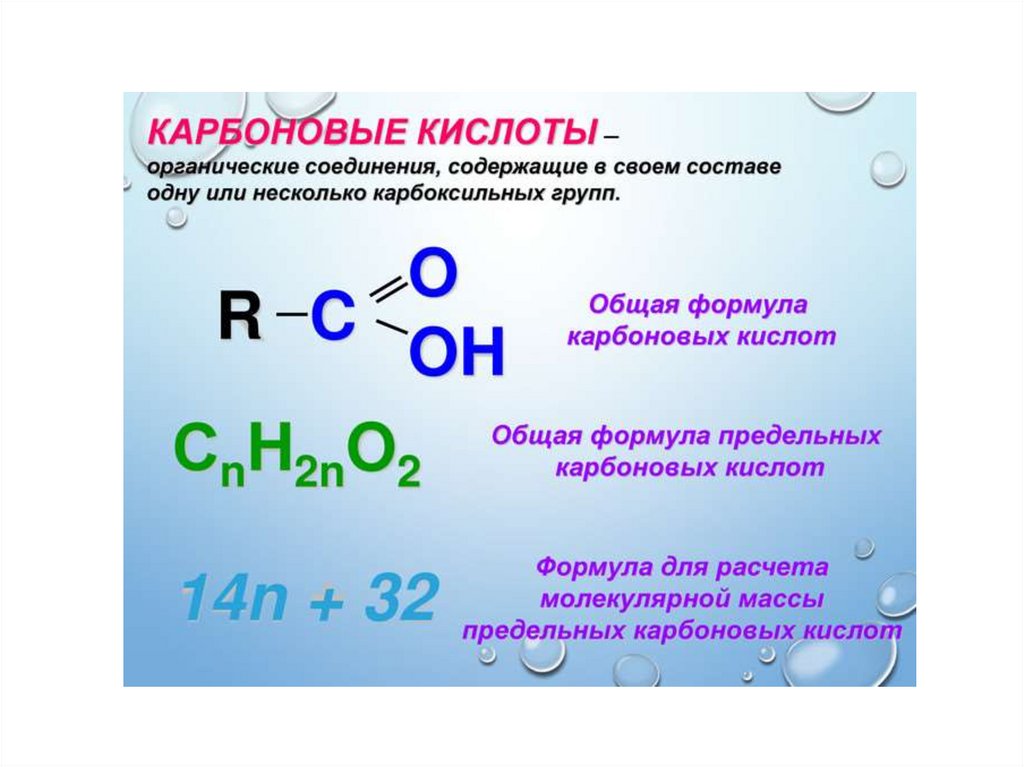
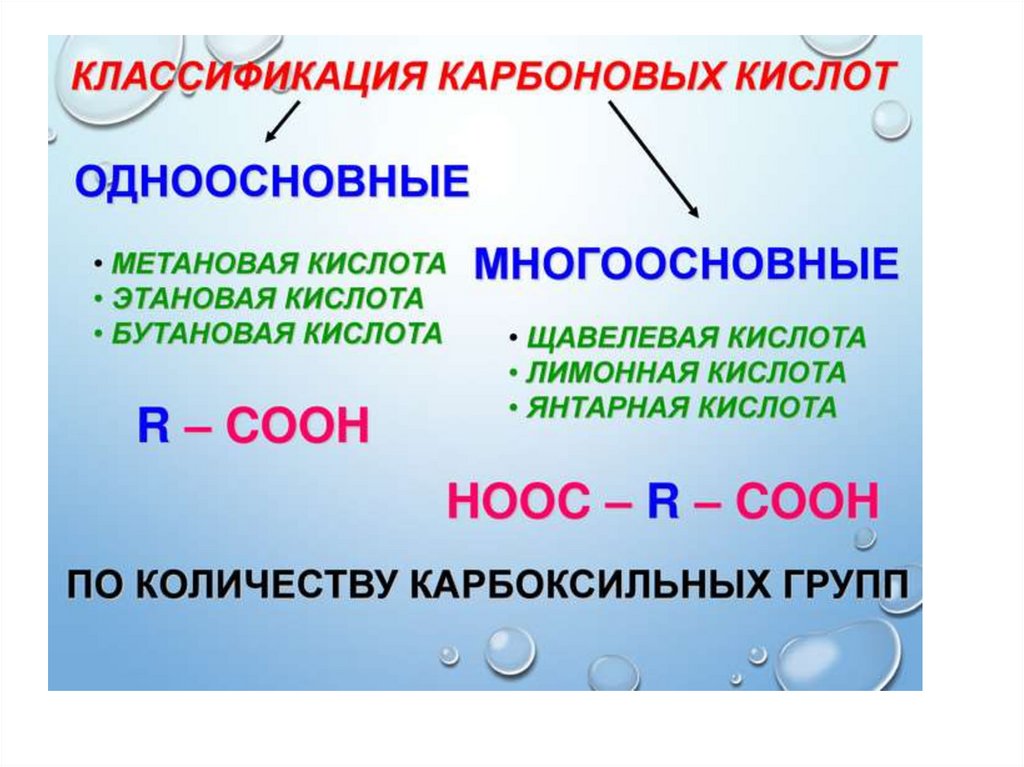
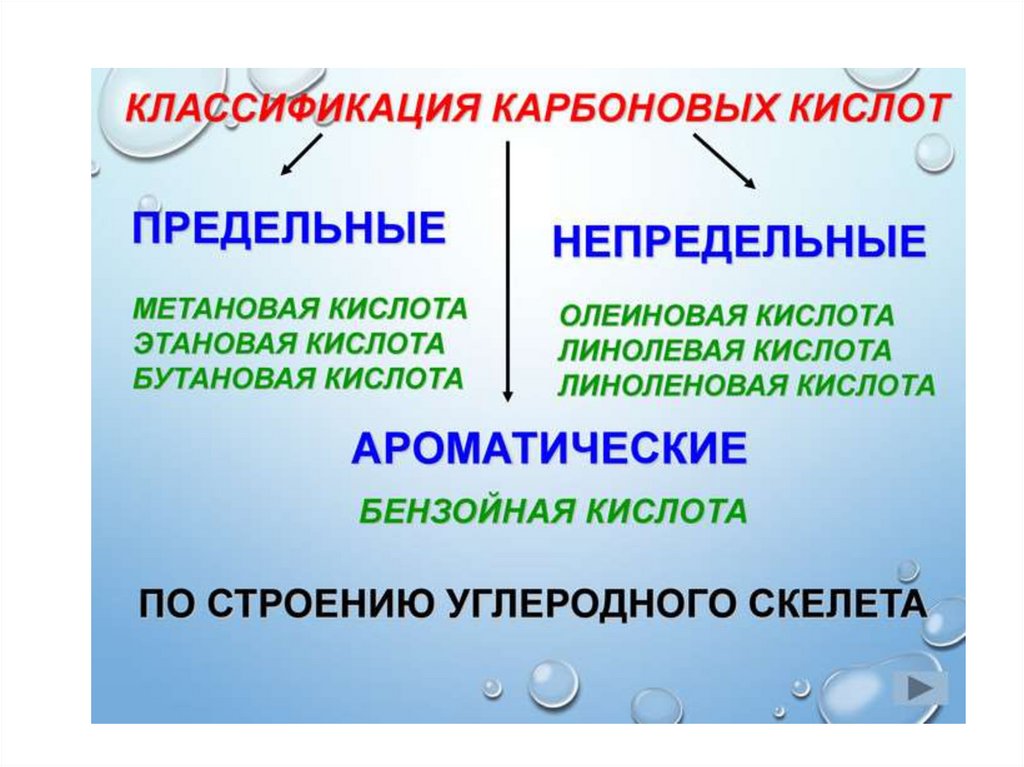
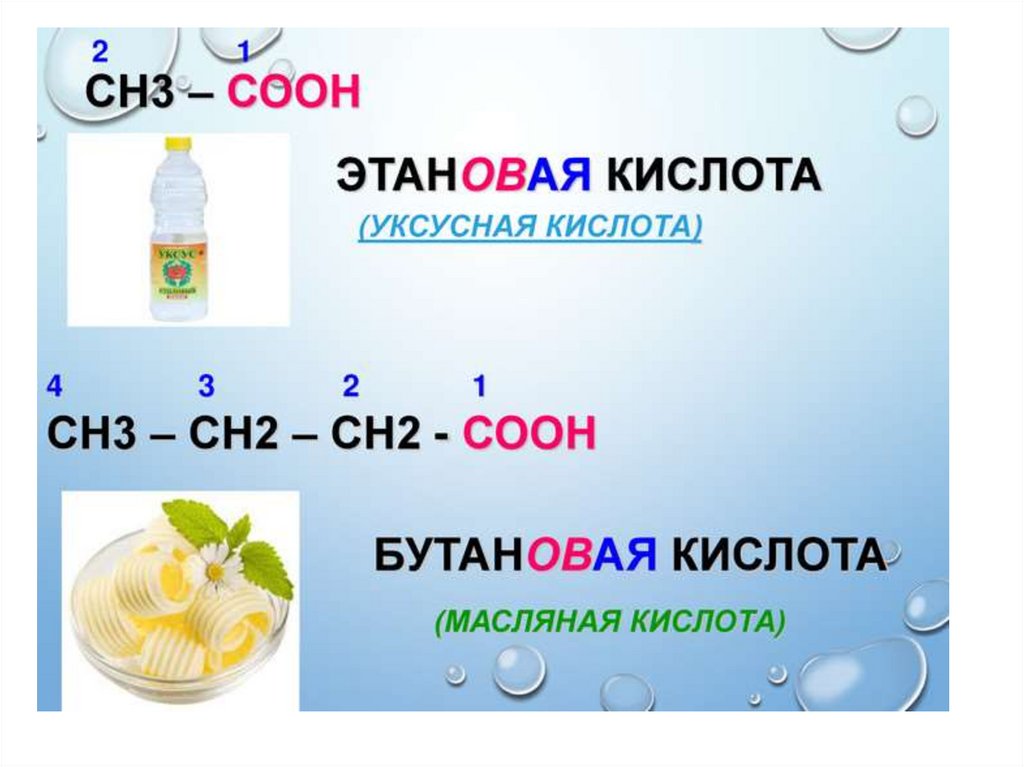
Карбоновые кислоты
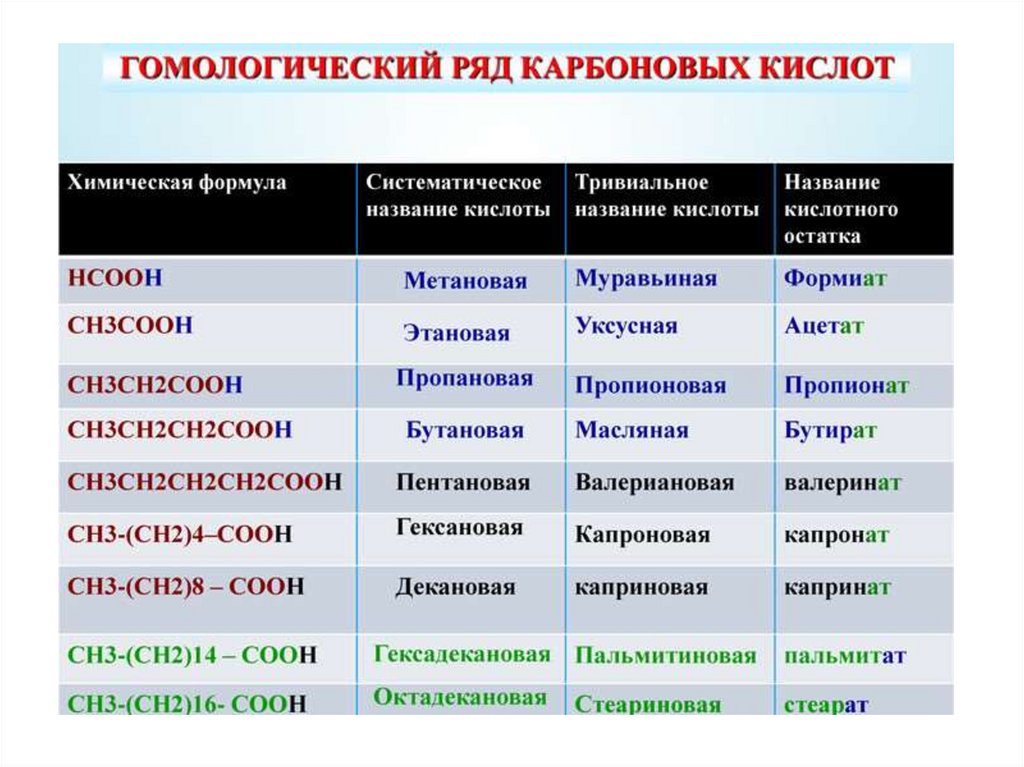
1.
2.
3.
4.
5.
6.
7.
8.
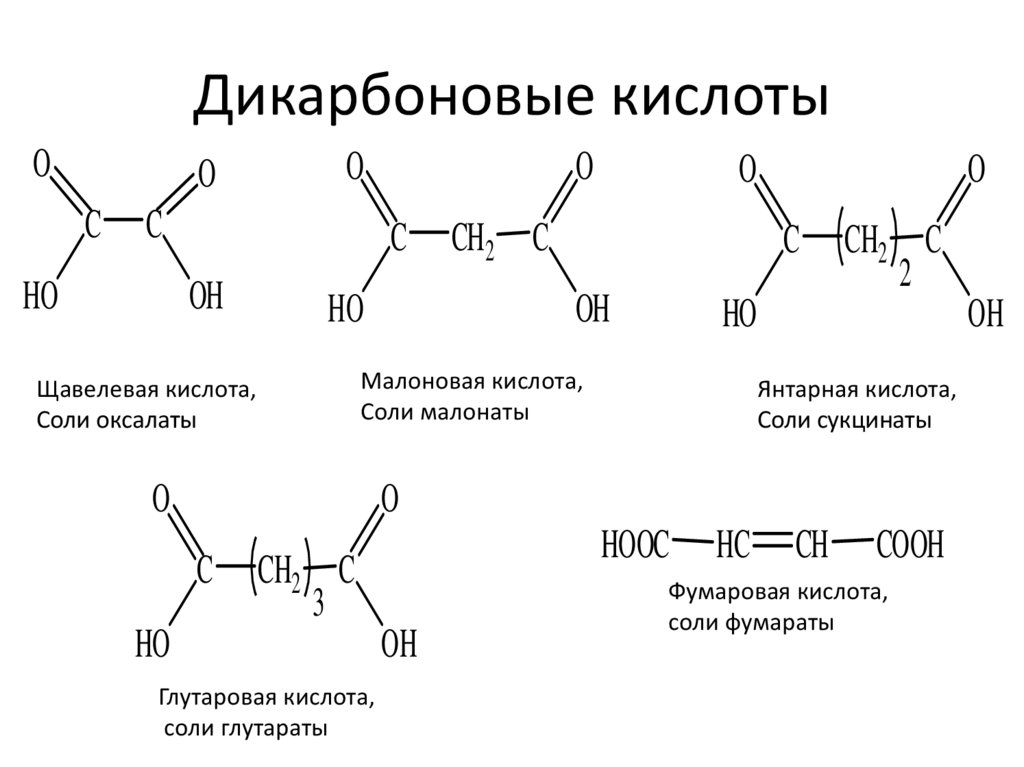
Дикарбоновые кислотыO
O
C
O
C
HO
O
C
OH
HO
O
CH2 C
C
OH
O
CH2 C
2
HO
Малоновая кислота,
Соли малонаты
Щавелевая кислота,
Соли оксалаты
O
OH
Янтарная кислота,
Соли сукцинаты
O
C
HOOC
CH2 C
3
HO
Глутаровая кислота,
соли глутараты
OH
HC
CH
COOH
Фумаровая кислота,
соли фумараты
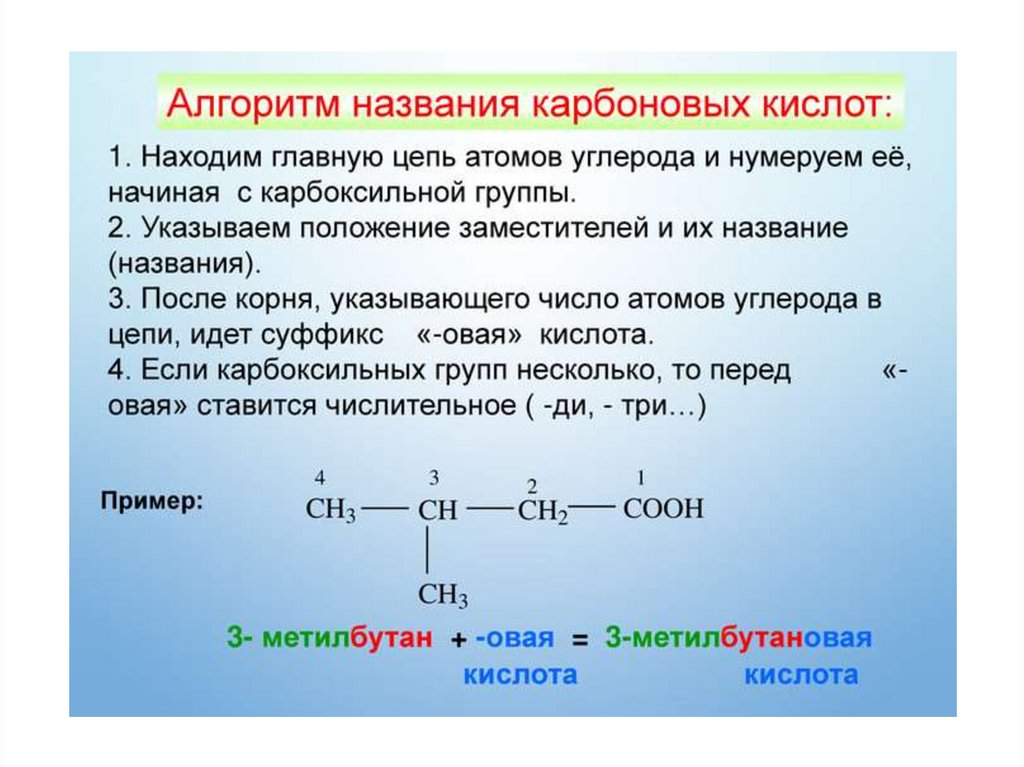
9.
10.
11.
12.
Строение карбоксильной группы● Электронная плотность в карбонильной группе (особенно σ-связи) смещена в
сторону кислорода, как более электроотрицательного элемента. Вследствие этого
карбонильный атом углерода приобретает частичный положительный заряд. Чтобы его
компенсировать, он притягивает к себе электроны атома кислорода гидроксильной
группы. Электронная плотность на атоме кислорода понижается и он смещает в свою
сторону электронную плотность связи О – Н. Полярность связи в гидроксогруппе
возрастает, водород становится подвижнее и легче отщепляется в виде протона, что
обуславливает общие свойства карбоновых кислот.
● Влияние радикала на карбоксильную группу объясняется сдвигом электронной
плотности к центральному атому углерода. В результате его частичный положительный
заряд уменьшается и его действие на электронную плотность атома кислорода –ОНгруппы ослабляется, а, значит, отщепление ионов водорода затрудняется. Как
следствие – самая сильная-муравьиная кислота.
● Карбоксильная группа влияет на радикал таким образом, что наиболее легко
замещаемым становится водород при α-углеродном атоме.
13.
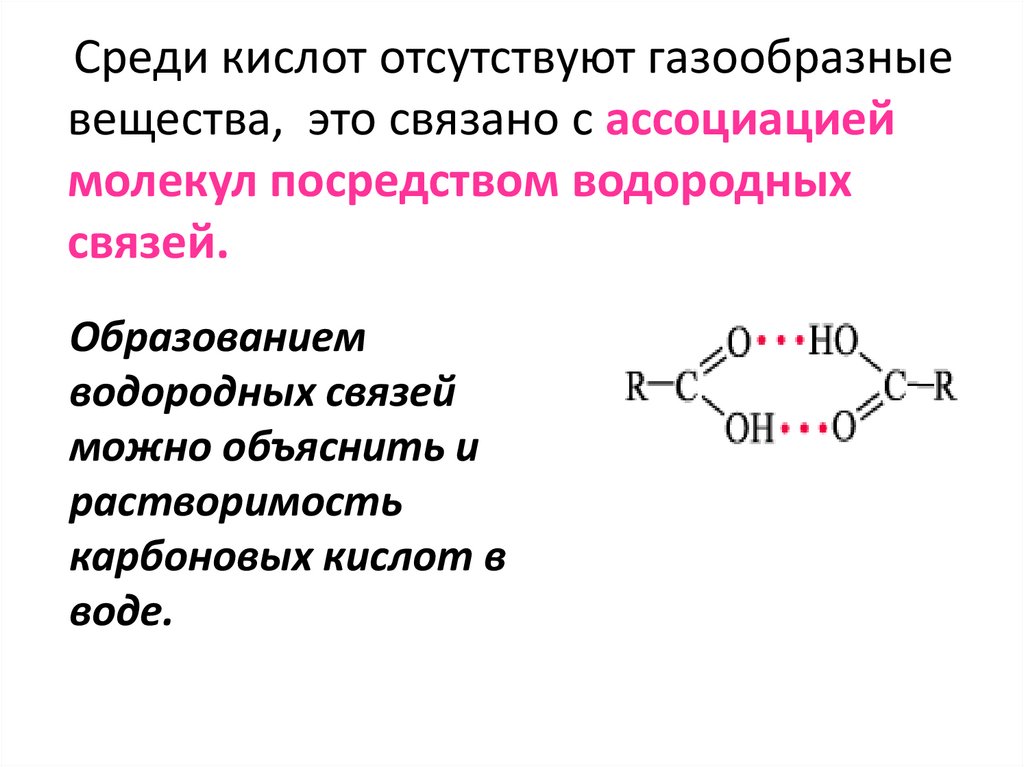
Среди кислот отсутствуют газообразныевещества, это связано с ассоциацией
молекул посредством водородных
связей.
Образованием
водородных связей
можно объяснить и
растворимость
карбоновых кислот в
воде.
14.
Реакционные центры:15.
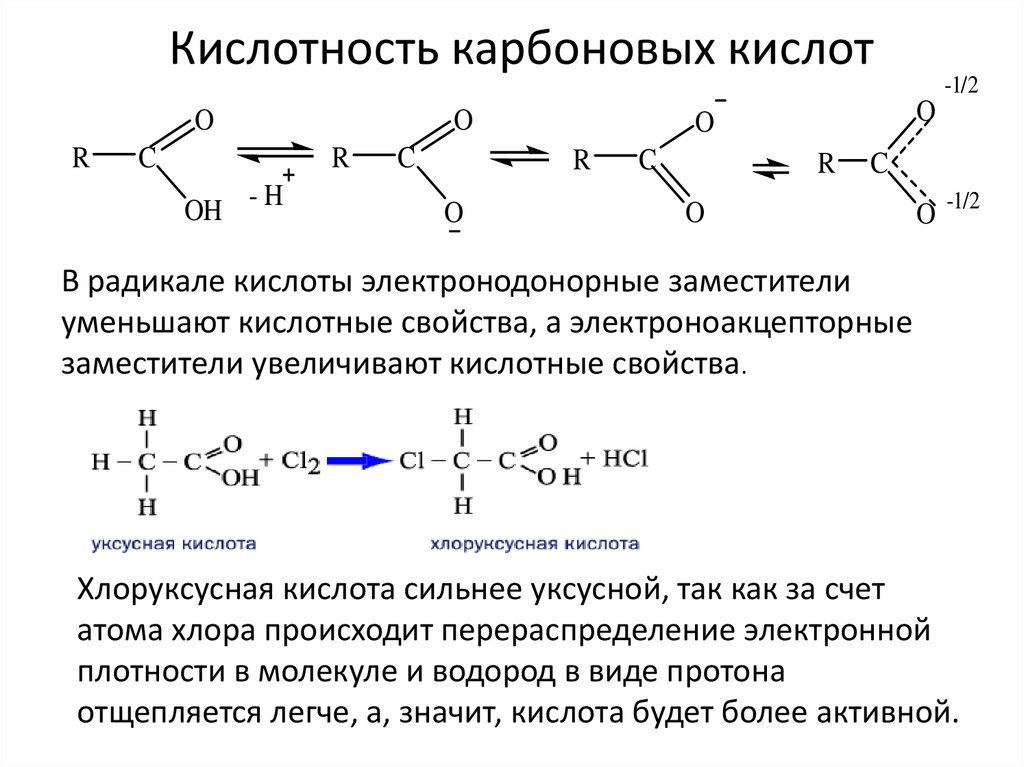
Кислотность карбоновых кислотO
R
O
C
R
OH
-H
C
O
O
O
R
C
-1/2
R
C
O
O
-1/2
В радикале кислоты электронодонорные заместители
уменьшают кислотные свойства, а электроноакцепторные
заместители увеличивают кислотные свойства.
Хлоруксусная кислота сильнее уксусной, так как за счет
атома хлора происходит перераспределение электронной
плотности в молекуле и водород в виде протона
отщепляется легче, а, значит, кислота будет более активной.
16.
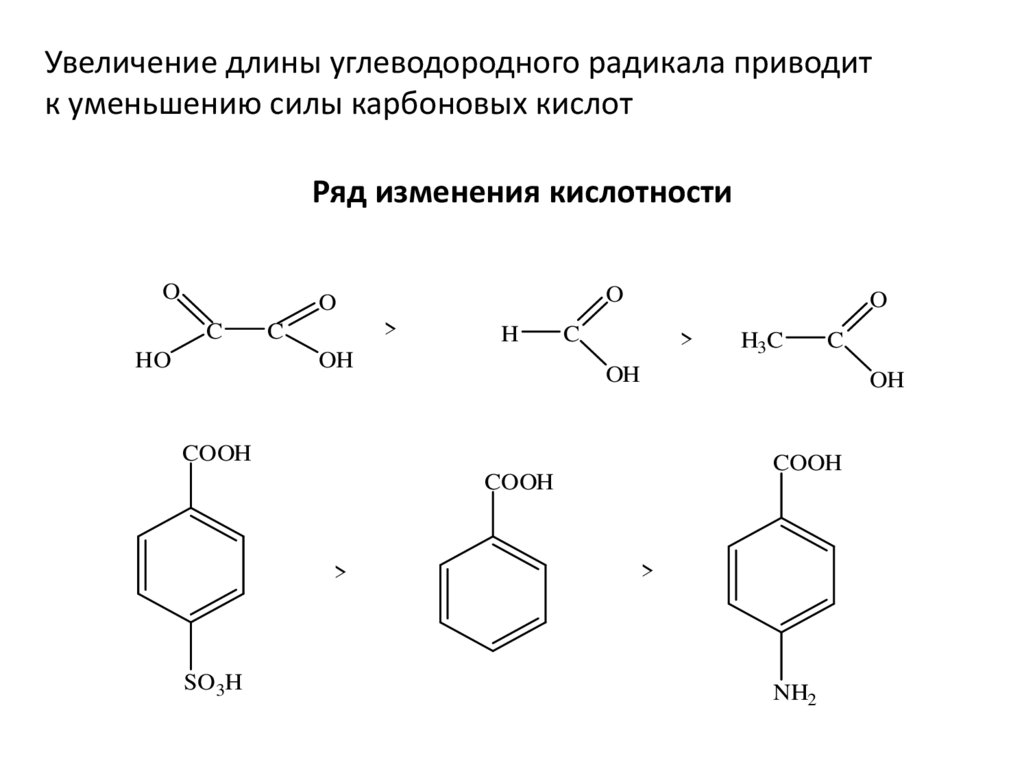
Увеличение длины углеводородного радикала приводитк уменьшению силы карбоновых кислот
Ряд изменения кислотности
O
O
O
C
HO
>
C
H
OH
O
C
>
OH
COOH
COOH
SO3H
C
OH
COOH
>
H3C
>
NH2
17.
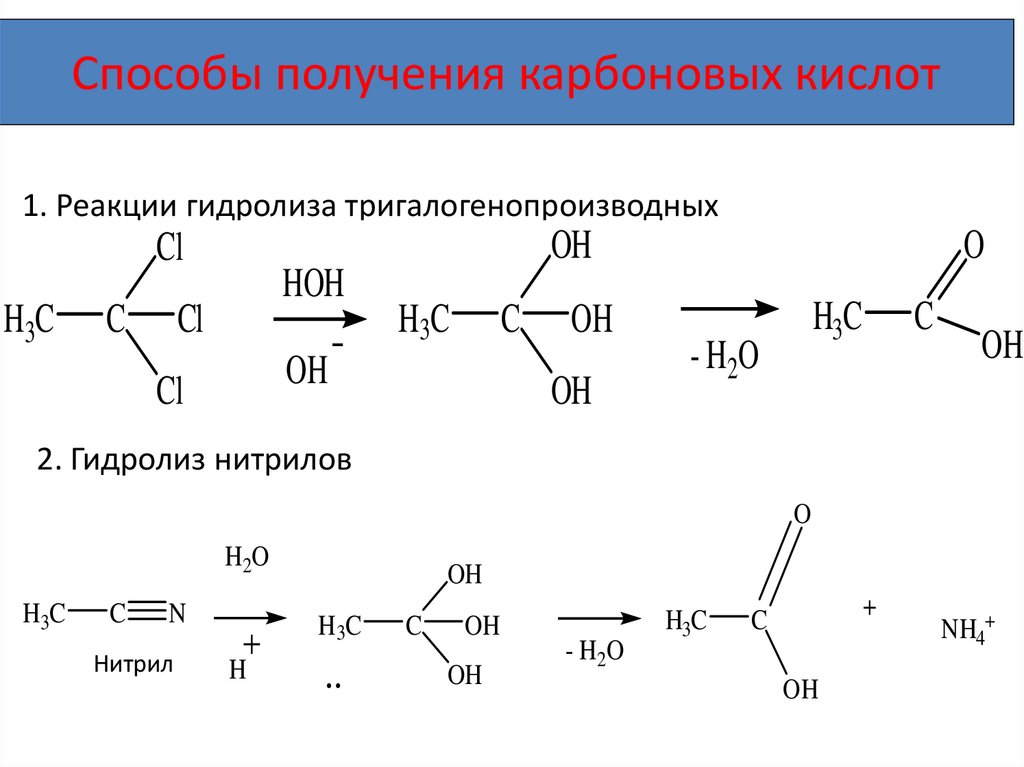
Способы получения карбоновых кислот1. Реакции гидролиза тригалогенопроизводных
OH
Cl
H3C
C
HOH
Cl
H3C
C
OH
Cl
OH
OH
O
H3C
- H2O
C
OH
2. Гидролиз нитрилов
O
H2O
H3C
C
N
Нитрил
OH
H3C
H
C
OH
OH
- H2O
H3C
+
C
OH
NH4+
18.
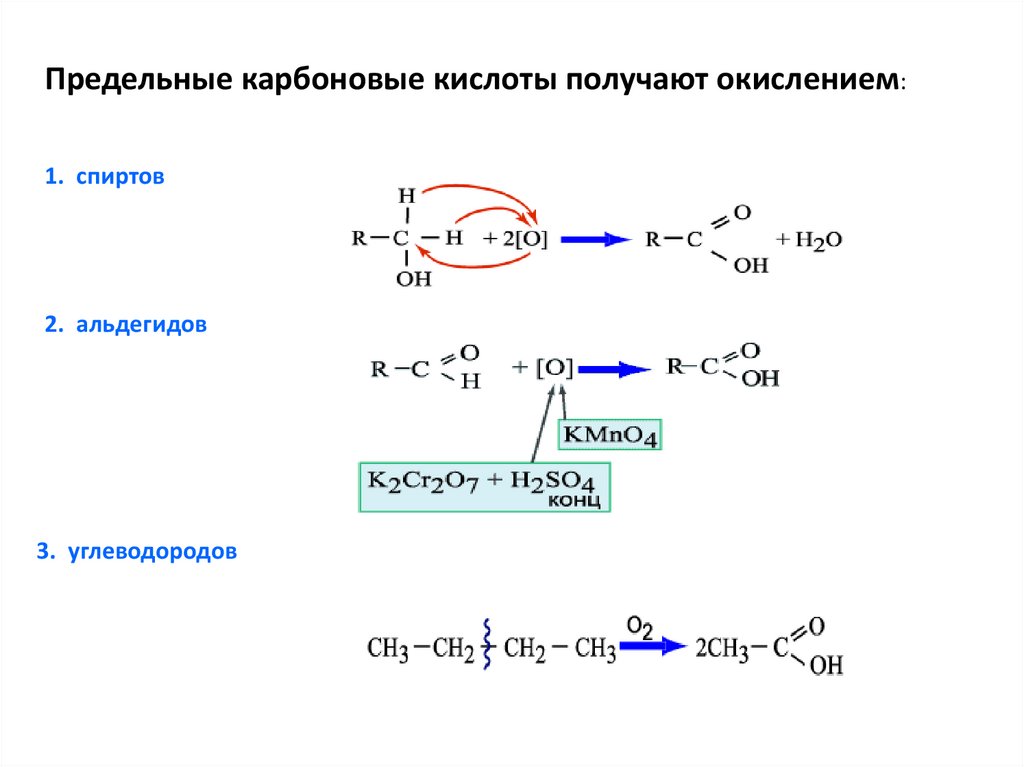
Предельные карбоновые кислоты получают окислением:1. спиртов
2. альдегидов
3. углеводородов
19.
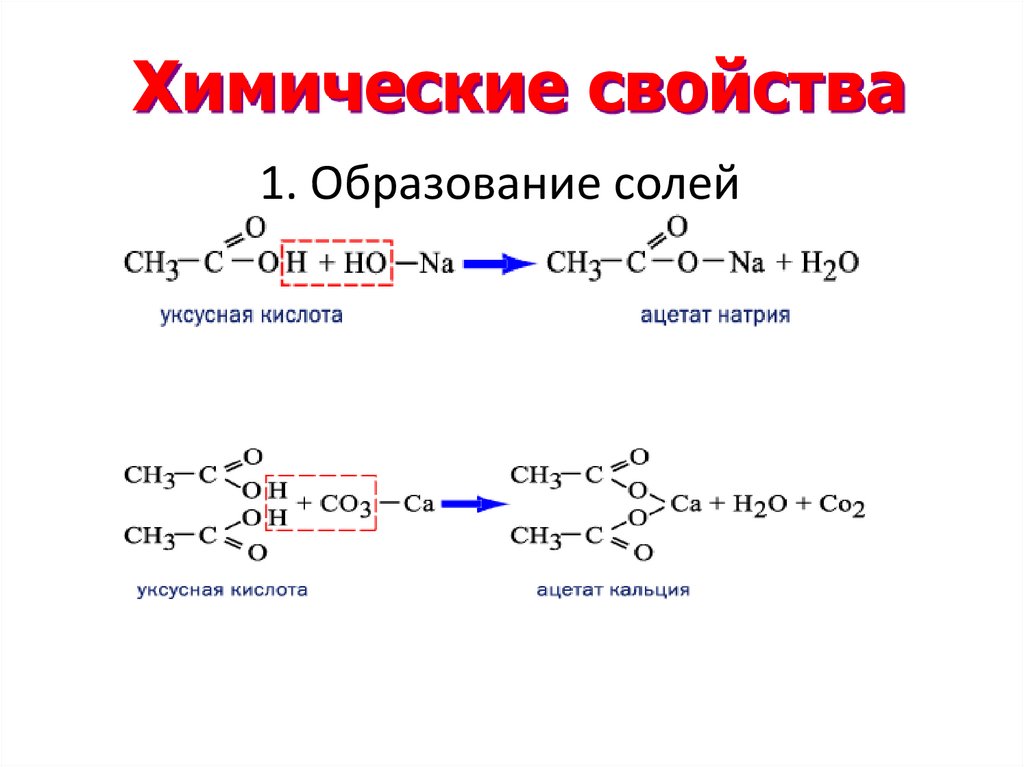
Химические свойства1. Образование солей
20.
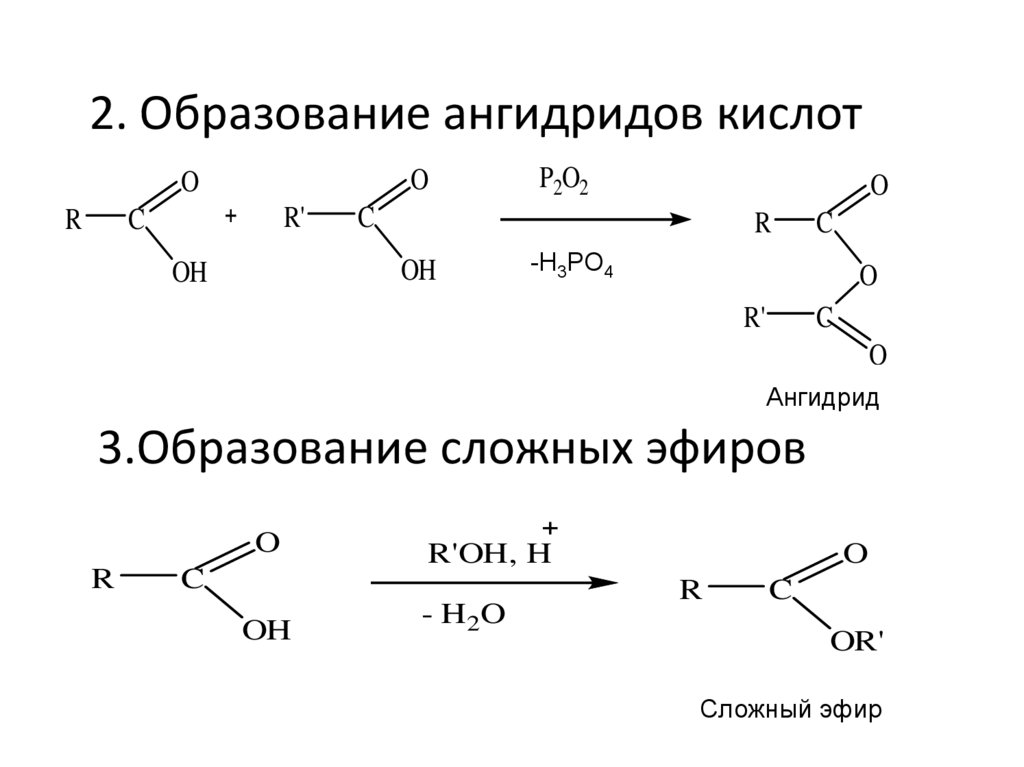
2. Образование ангидридов кислотO
O
R
R'
C
O
C
R
OH
OH
P2O2
C
-Н3РО4
O
R'
C
O
Ангидрид
3.Образование сложных эфиров
O
R
C
OH
R'OH, H
- H2O
O
R
C
OR'
Сложный эфир
21.
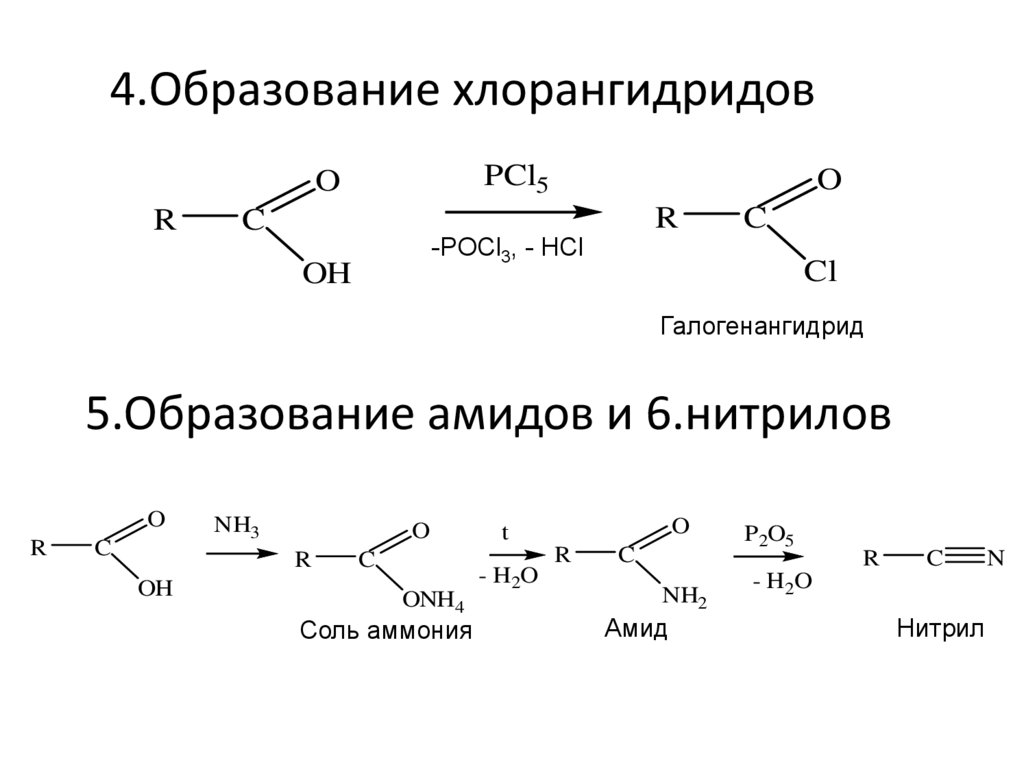
4.Образование хлорангидридовPCl5
O
R
O
R
C
C
-POCl3, - HCl
OH
Cl
Галогенангидрид
5.Образование амидов и 6.нитрилов
O
R
C
NH3
O
R
OH
C
ONH4
Соль аммония
O
t
- H2O
R
C
NH2
Амид
P2O5
R
C
- H2O
Нитрил
N






 Химия
Химия








