Похожие презентации:
Непредельные углеводороды
1.
Непредельныеуглеводороды
Лекция 4
2.
АЛКЕНЫ• Алкены (олефины, этиленовые углеводороды) ациклические непредельные углеводороды,
содержащие одну двойную связь между
атомами углерода, образующие гомологический
ряд с общей формулой CnH2n.
• Изомерия: - углеродного скелета
- положения = связи
- геометрическая
3.
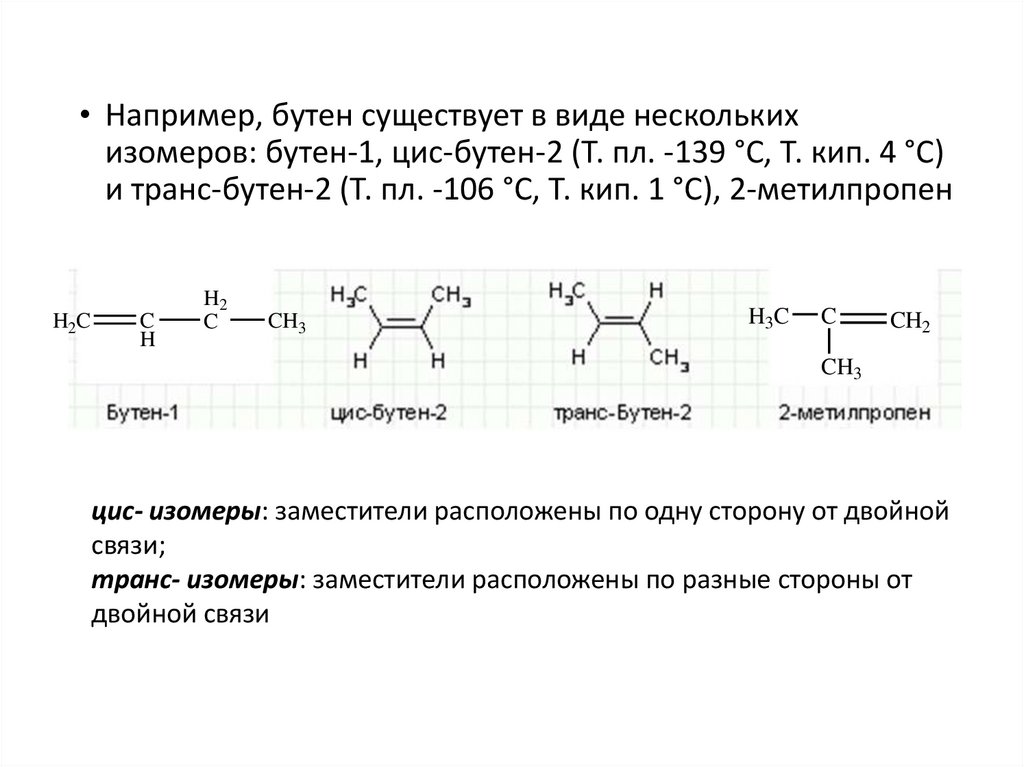
• Например, бутен существует в виде несколькихизомеров: бутен-1, цис-бутен-2 (Т. пл. -139 °С, Т. кип. 4 °С)
и транс-бутен-2 (Т. пл. -106 °С, Т. кип. 1 °С), 2-метилпропен
H2C
C
H
H2
C
CH3
H3C
C
CH2
CH3
цис- изомеры: заместители расположены по одну сторону от двойной
связи;
транс- изомеры: заместители расположены по разные стороны от
двойной связи
4.
История открытия• Впервые этилен был получен в 1669 году немецким
химиком и врачом Бехером действием серной
кислоты на этиловый спирт.
• Вторично и тем же способом был получен и описан
голландскими химиками Дейманом, Потс-ванТрооствиком, Бондом и Лауверенбургом в 1795
году. Они назвали его «маслородным газом» так
как при взаимодействии с хлором, он образовывал
маслянистую жидкость — дихлорэтан.
• По-французски «маслородный» - oléfiant.
Французский химик Антуан Фуркруа ввёл этот
термин в практику это название стало общим для
всего класса олефинов (или алкенов).
• В 1862 году немецкий химик-органик Э. Эрленмейер
предположил наличие в молекуле этилена двойной
связи, а в 1870 году известный российский учёный А.
М. Бутлеров признал эту точку зрения правильной,
подтвердив её природу экспериментально
5.
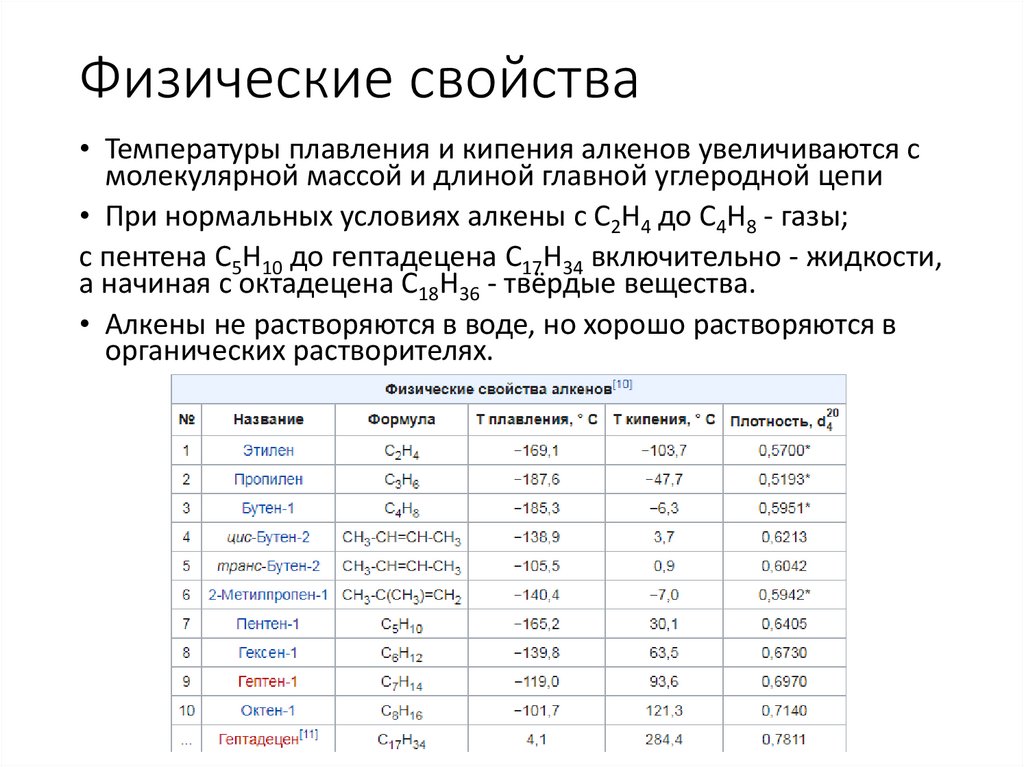
Физические свойства• Температуры плавления и кипения алкенов увеличиваются с
молекулярной массой и длиной главной углеродной цепи
• При нормальных условиях алкены с C2H4 до C4H8 - газы;
с пентена C5H10 до гептадецена C17H34 включительно - жидкости,
а начиная с октадецена C18H36 - твёрдые вещества.
• Алкены не растворяются в воде, но хорошо растворяются в
органических растворителях.
6.
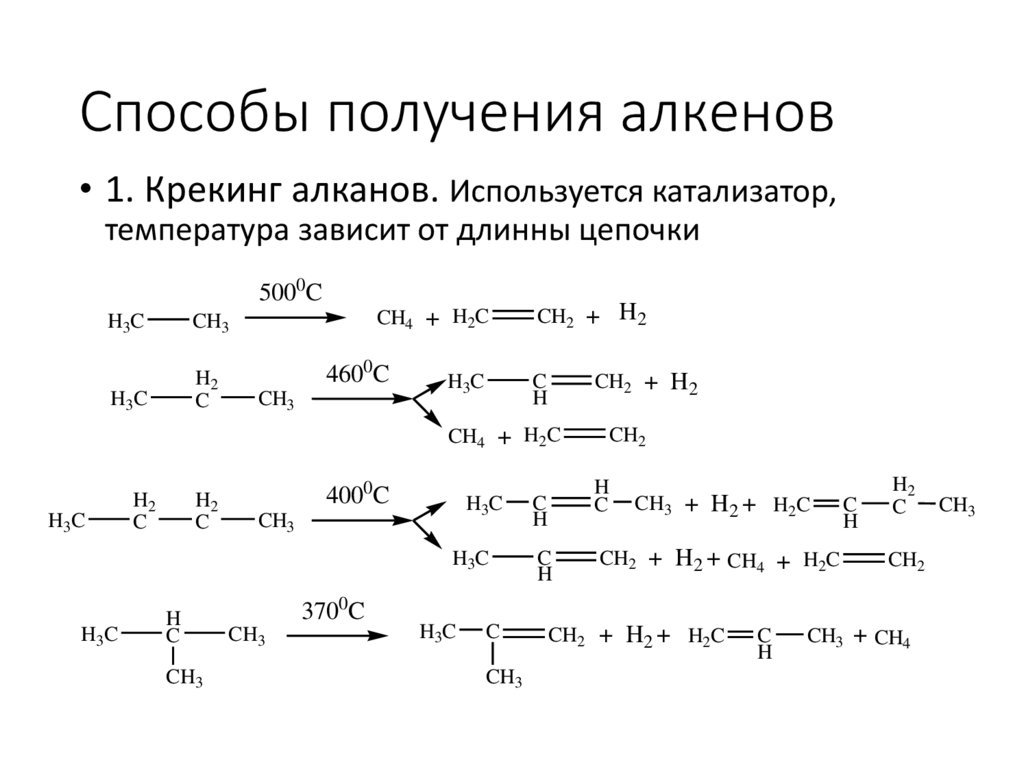
Способы получения алкенов• 1. Крекинг алканов. Используется катализатор,
температура зависит от длинны цепочки
5000C
H3C
CH3
H3C
H2
C
CH4 + H2C
4600C
CH3
H3C
CH2 + H2
CH2 + H2
C
H
CH4 + H2C
H3C
H2
C
H2
C
4000C
H3C
CH3
H3C
H3C
H
C
CH3
3700C
CH3
H3C
C
CH3
CH2
H
C
C
H
C
H
CH3 + H2 + H2C
CH2 + H2 + CH4 + H2C
CH2 + H2 + H2C
C
H
C
H
H2
C
CH2
CH3 + CH4
CH3
7.
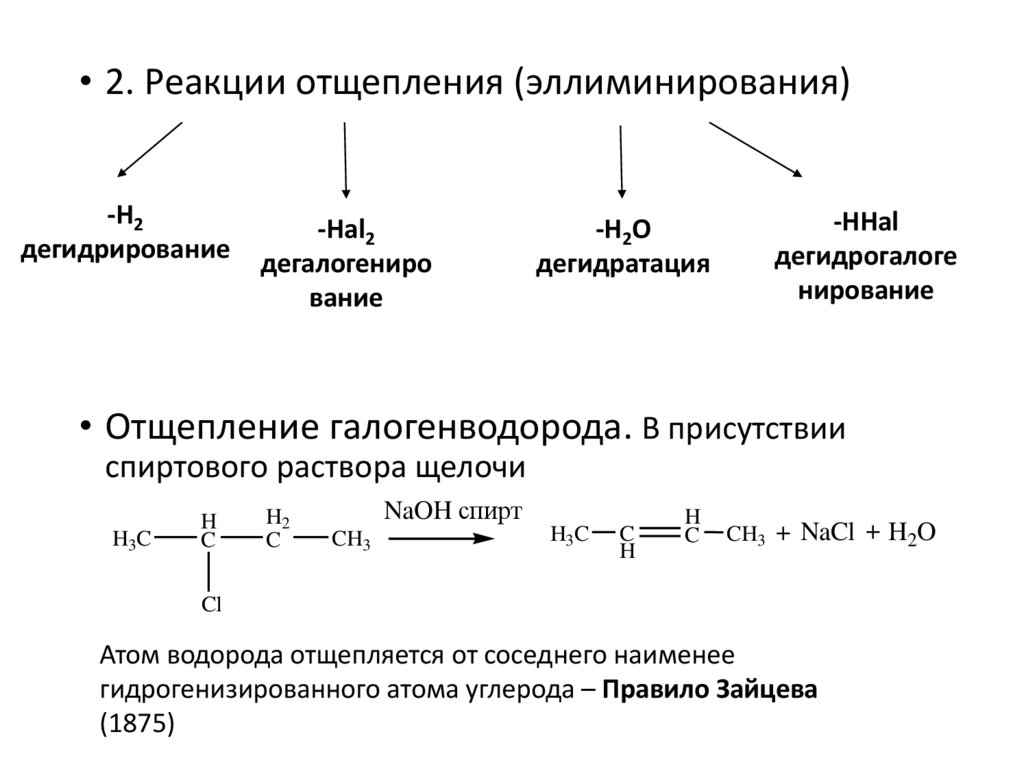
• 2. Реакции отщепления (эллиминирования)-H2
дегидрирование
-Hal2
дегалогениро
вание
-H2О
дегидратация
-HHal
дегидрогалоге
нирование
• Отщепление галогенводорода. В присутствии
спиртового раствора щелочи
H3C
H
C
H2
C
NaOH спирт
CH3
H3C
C
H
H
C
CH3 + NaCl + H2O
Cl
Атом водорода отщепляется от соседнего наименее
гидрогенизированного атома углерода – Правило Зайцева
(1875)
8.
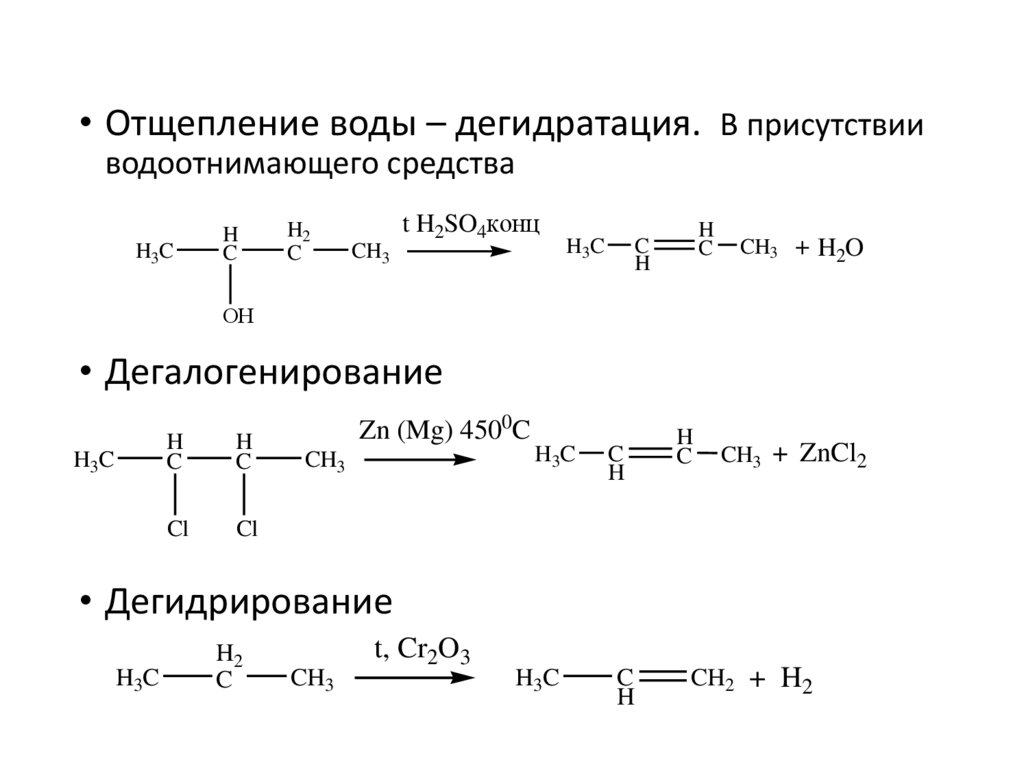
• Отщепление воды – дегидратация. В присутствииводоотнимающего средства
H3C
H
C
H2
C
t H2SO4конц
CH3
H3C
H
C
C
H
CH3 + H2O
ОН
• Дегалогенирование
H3C
H
C
H
C
Cl
Cl
Zn (Mg) 4500C
H3C
CH3
C
H
H
C
CH3 + ZnCl2
• Дегидрирование
H3C
H2
C
CH3
t, Cr2O3
H3C
C
H
CH2 + H2
9.
Особенности строения• Молекулы алкенов содержат двойную связь,
образованную одной σ- и одной π-связью
• Атомы углерода находятся в состоянии sp2гибридизации, имеют плоскую геометрию с
валентным углом между осями гибридных
орбиталей 120°
π-связь менее прочна,
чем σ-связь, поэтому
для непредельных
соединений
характерны реакции, в
которых π-связь
разрушается
10.
Реакционная способность алкенов• Алкены химически активны. Их химические
свойства во многом определяются наличием
двойной связи
• Для алкенов наиболее характерны реакции
электрофильного присоединения,
протекающие с разрывом π-связи
• Алкены легко вступают в реакции окисления,
гидрируются сильными восстановителями или
водородом под действием катализаторов, а
также способны к радикальному замещению
11.
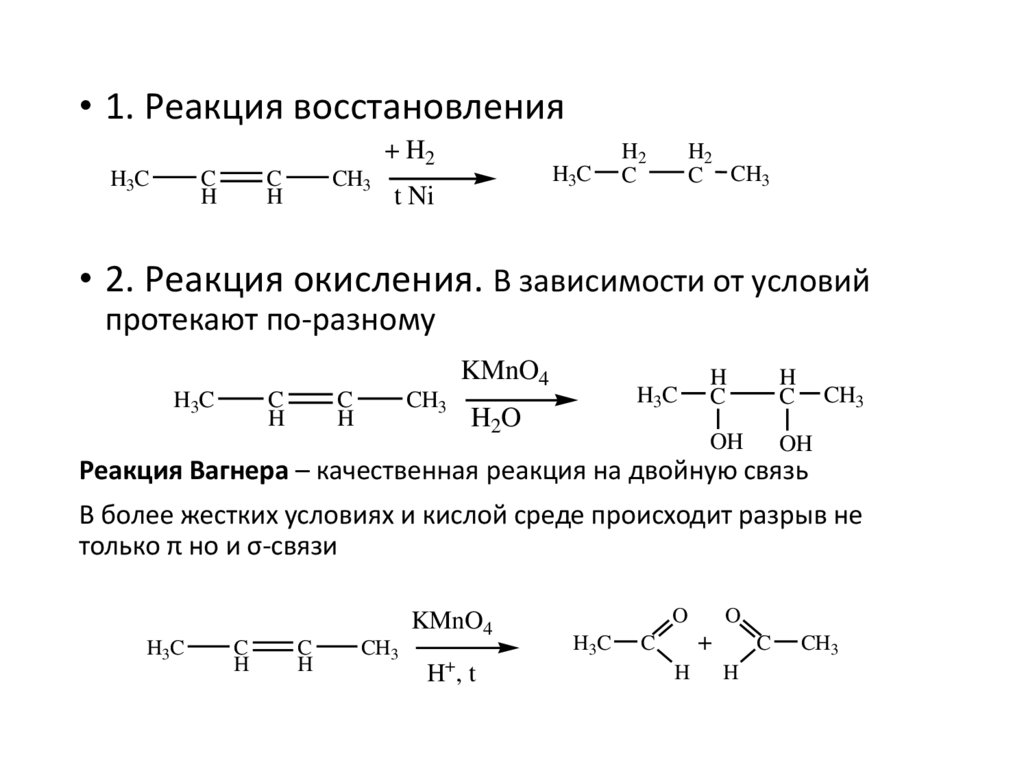
• 1. Реакция восстановления+ H2
H3C
C
H
C
H
CH3
H3C
t Ni
H2
C
H2
C CH3
• 2. Реакция окисления. В зависимости от условий
протекают по-разному
KMnO4
H3C
C
H
C
H
CH3
H3C
H2O
H
C
H
C
OH
OH
CH3
Реакция Вагнера – качественная реакция на двойную связь
В более жестких условиях и кислой среде происходит разрыв не
только π но и σ-связи
KMnO4
H3C
C
H
C
H
CH3
+
H ,t
O
H3C
O
+
C
H
C
H
CH3
12.
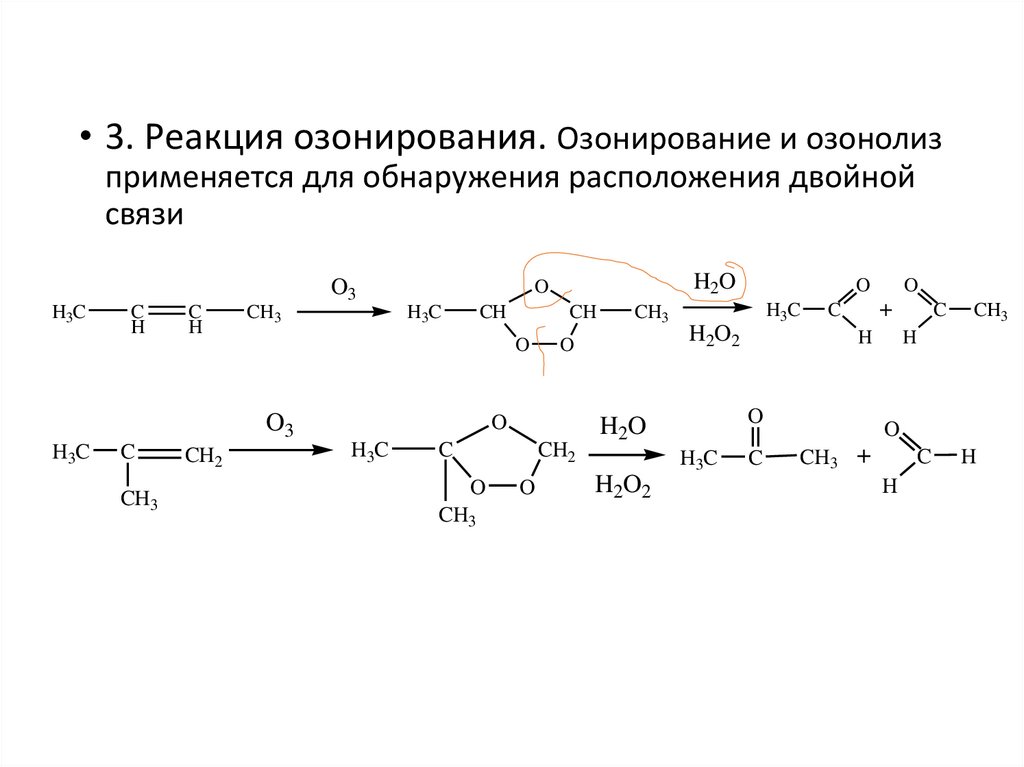
• 3. Реакция озонирования. Озонирование и озонолизприменяется для обнаружения расположения двойной
связи
O3
H3C
C
H
C
H
CH3
H3C
CH
CH
O
O3
H3C
C
CH3
CH2
H2O
O
O
O
H3C
C
CH2
O
CH3
O
CH3
H3C
H2O2
H3C
O
+
C
H
O
H2O
H2O2
O
C
C
CH3
H
O
CH3 +
C
H
H
13.
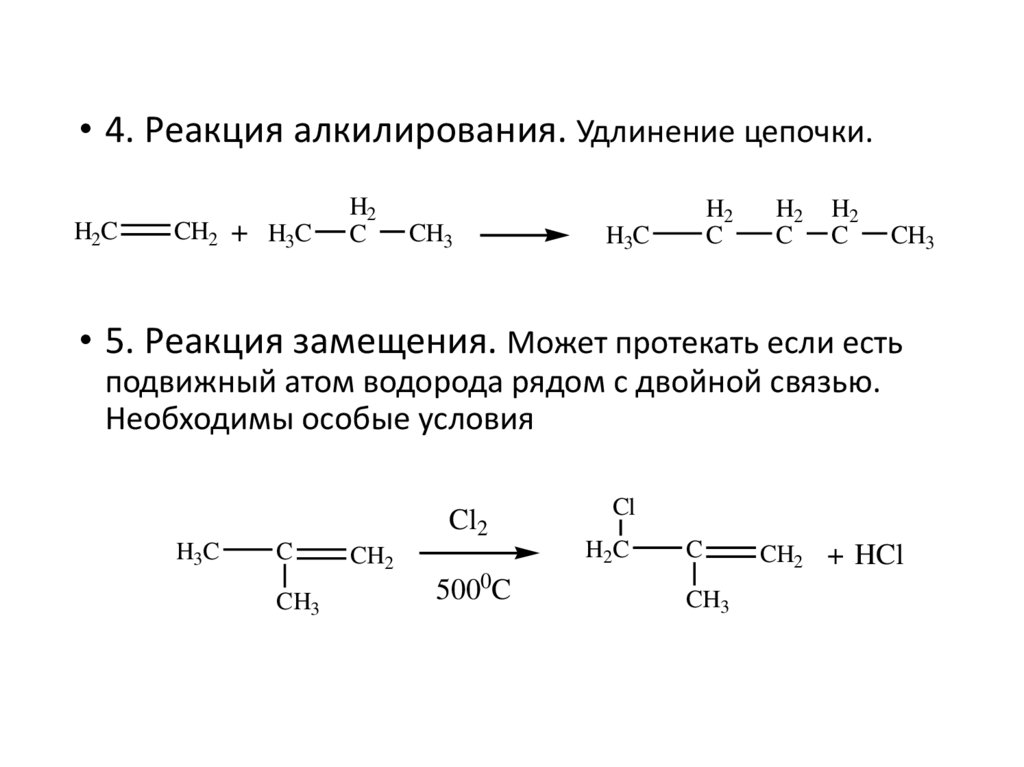
• 4. Реакция алкилирования. Удлинение цепочки.H2C
CH2 + H3C
H2
C
CH3
H2
C
H3C
H2
C
H2
C
CH3
• 5. Реакция замещения. Может протекать если есть
подвижный атом водорода рядом с двойной связью.
Необходимы особые условия
Cl2
H3C
C
CH3
CH2
5000C
Cl
H2C
C
CH3
CH2 + HCl
14.
• 6. Реакция присоединения (электрофильного) АЕСамые характерные реакции для алкенов.
1) Галогенирование (присоединение галогена)
Br
Br2
H2C
CH2
H2C
Br
CH2
Реакция с бромной водой – качественная реакция на двойную связь
2) Присоединение галогенводорода
Идет по правилу Марковникова. Если регент присоединяются к
несимметричному алкену, то водород присоединяется к наиболее
гидрогенизированному атому углерода двойной связи, а галоген – к
другому, т.е. наименее гидрогенизированному
Cl
HCl
H3C
C
CH3
CH2
H3C
C
CH3
CH3
15.
• Современная трактовка правила:Электроположительная частица реагента
присоединяется к атому углерода,
содержащее большее число атомов
водорода, а электроотрицательная частица к
атому углерода с меньшим числом атомов
водорода
+δ
I
H3C
C
H
-δ
Cl
CH2
H3C
Cl
I
C
H
CH2
• В присутствии пероксидов реакция
присоединения идет против правила
Марковникова
HCl
H3C
C
H
CH2
H2O2
H3C
H2
C
H2
C
Cl
16.
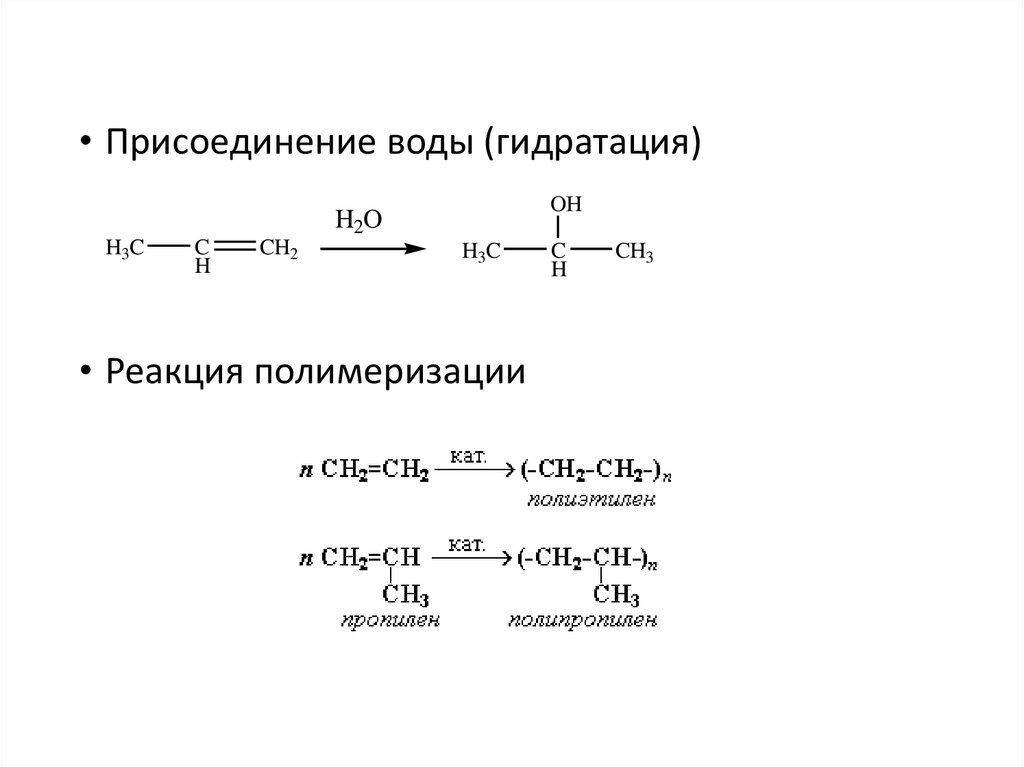
• Присоединение воды (гидратация)OH
H2O
H3C
C
H
CH2
H3C
• Реакция полимеризации
C
H
CH3
17.
АЛКИНЫ• Алкины (ацетиленовые углеводороды) углеводороды, содержащие тройную связь
между атомами углерода, образующие
гомологический ряд с общей формулой CnH2n-2
• Изомерия - углеродного скелета
- положения тройной связи
18.
История открытия• Впервые ацетилен был получен в 1836 году
Эдмундом Дэви нагреванием уксуснокислого
калия с древесным углем и последующей
реакцией с водой образовавшегося карбида
калия. Дэви назвал свой газ «двууглеродистым
водородом».
• В 1862 году немецкий химик и врач Ф. Вёлер вновь
открыл ацетилен, действуя водой на карбид
кальция.
• В 1863 году французский химик М. Бертло получил
ацетилен, пропуская водород над раскалёнными
электрической дугой графитовыми электродами.
Именно он дал газу имя ацетилен (от латинских
слов acetum — уксус и греческого иле — дерево).
Русское название «ацетилен» впервые было
применено Д. И. Менделеевым
19.
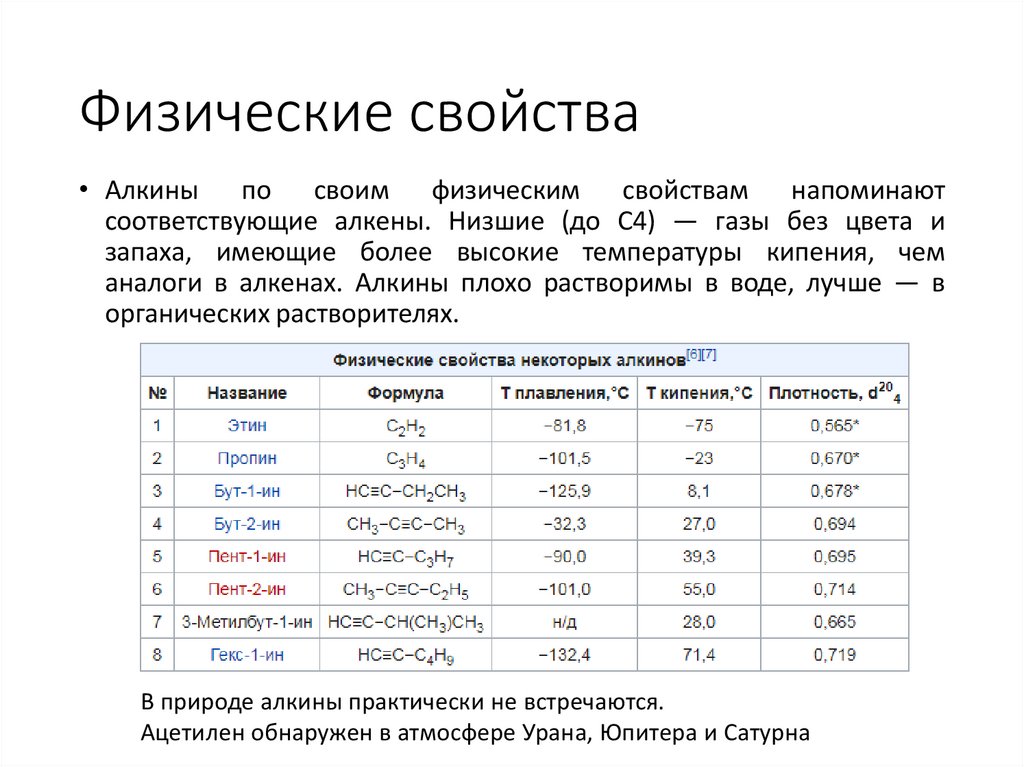
Физические свойства• Алкины по своим физическим свойствам напоминают
соответствующие алкены. Низшие (до С4) — газы без цвета и
запаха, имеющие более высокие температуры кипения, чем
аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в
органических растворителях.
В природе алкины практически не встречаются.
Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна
20.
Способы получения алкинов• 1. Прямой синтез. при 3000 °С, используя электрическую
дугу между угольными электродами в токе водорода
• 2. Термолиз метана. 1000-1500 °С
CH4
CH + H2
HC
• 3. Из алканов или алкенов
t, Ni,Pt
H3C
CH3
-H2
t, Ni,Pt
H2C
CH2
-H2
HC
CH
21.
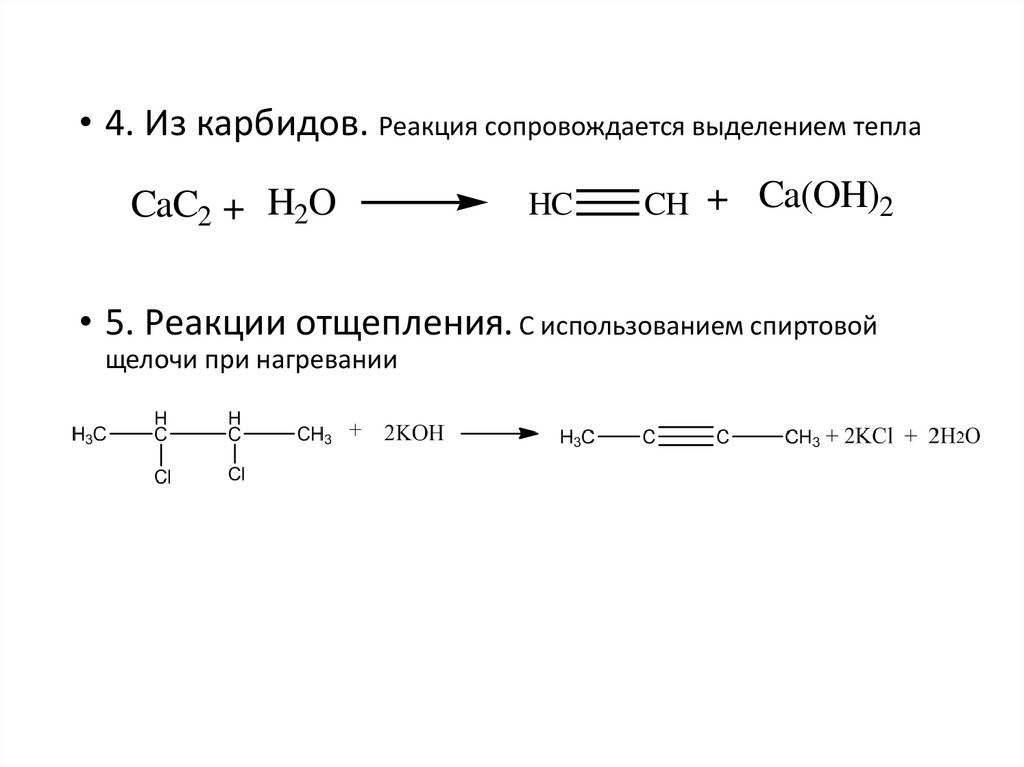
• 4. Из карбидов. Реакция сопровождается выделением теплаCaC2 + H2O
HC
CH + Ca(OH)2
• 5. Реакции отщепления. С использованием спиртовой
щелочи при нагревании
22.
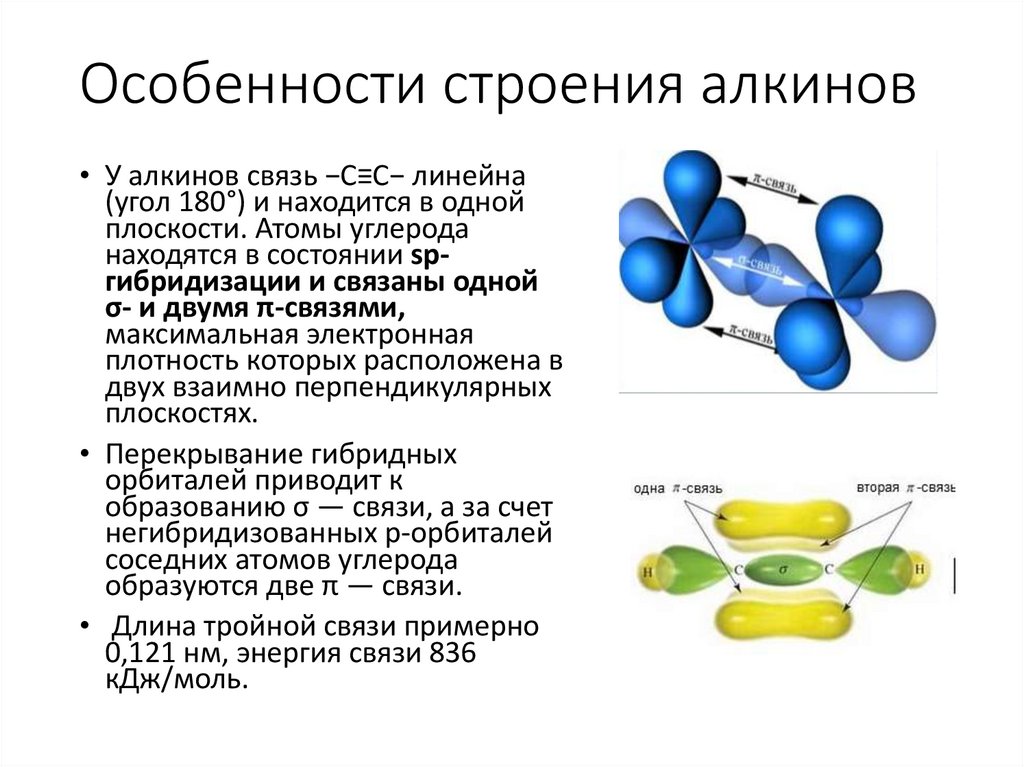
Особенности строения алкинов• У алкинов связь −С≡С− линейна
(угол 180°) и находится в одной
плоскости. Атомы углерода
находятся в состоянии spгибридизации и связаны одной
σ- и двумя π-связями,
максимальная электронная
плотность которых расположена в
двух взаимно перпендикулярных
плоскостях.
• Перекрывание гибридных
орбиталей приводит к
образованию σ — связи, а за счет
негибридизованных р-орбиталей
соседних атомов углерода
образуются две π — связи.
• Длина тройной связи примерно
0,121 нм, энергия связи 836
кДж/моль.
23.
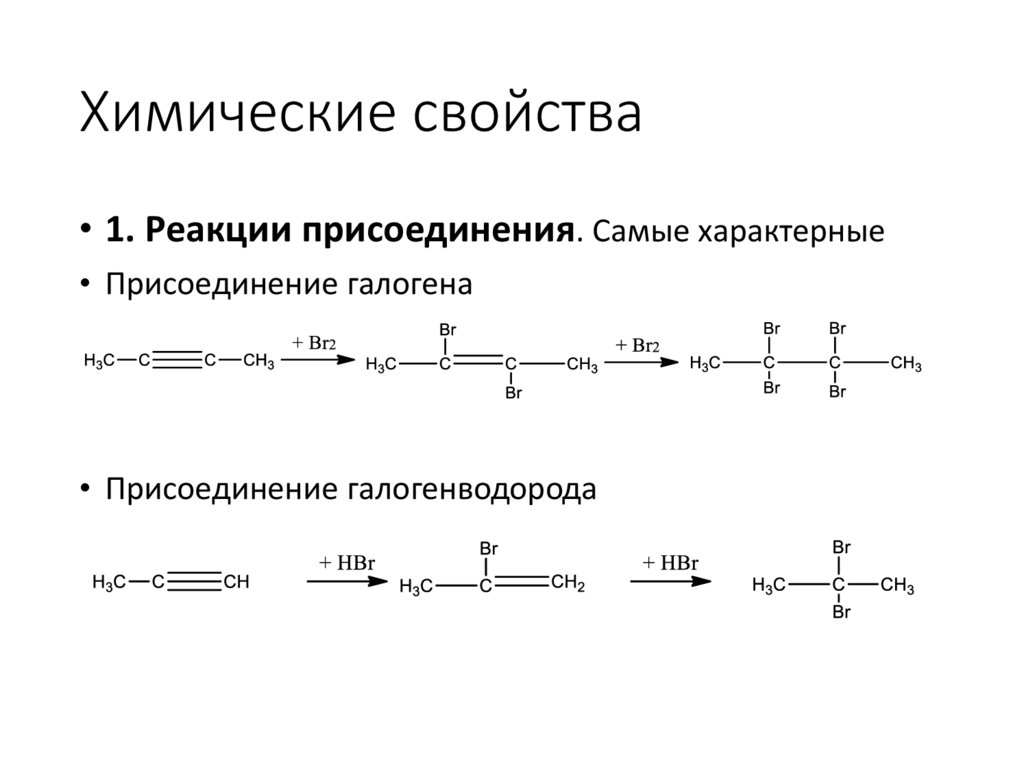
Химические свойства• 1. Реакции присоединения. Самые характерные
• Присоединение галогена
• Присоединение галогенводорода
24.
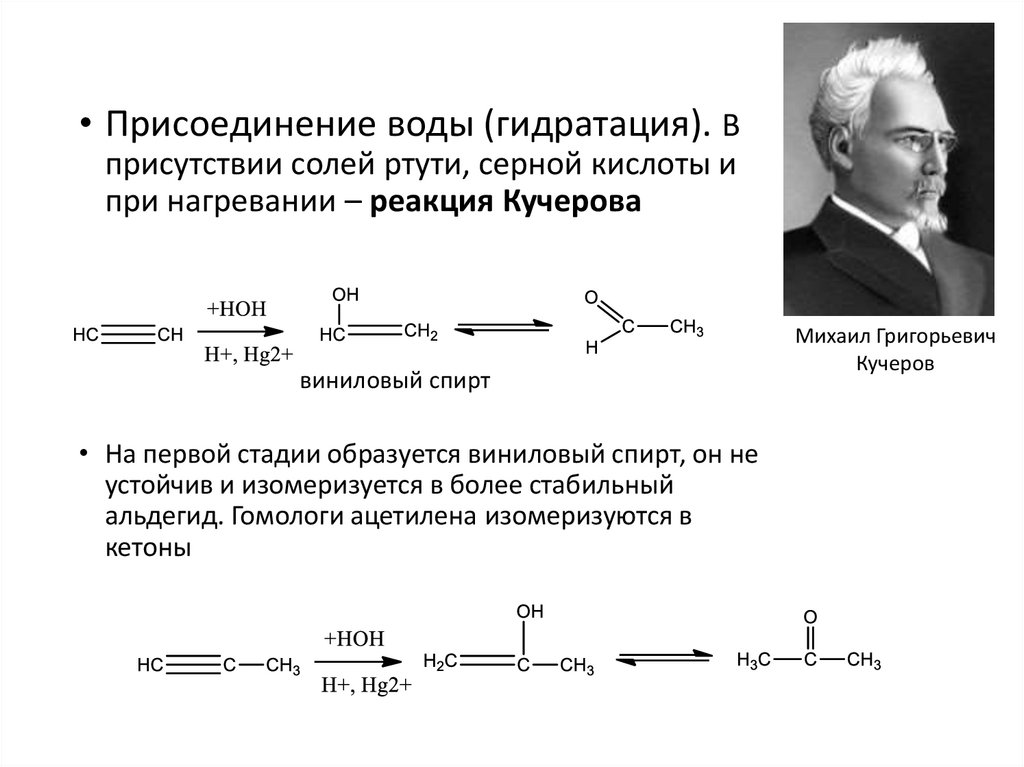
• Присоединение воды (гидратация). Вприсутствии солей ртути, серной кислоты и
при нагревании – реакция Кучерова
виниловый спирт
• На первой стадии образуется виниловый спирт, он не
устойчив и изомеризуется в более стабильный
альдегид. Гомологи ацетилена изомеризуются в
кетоны
Михаил Григорьевич
Кучеров
25.
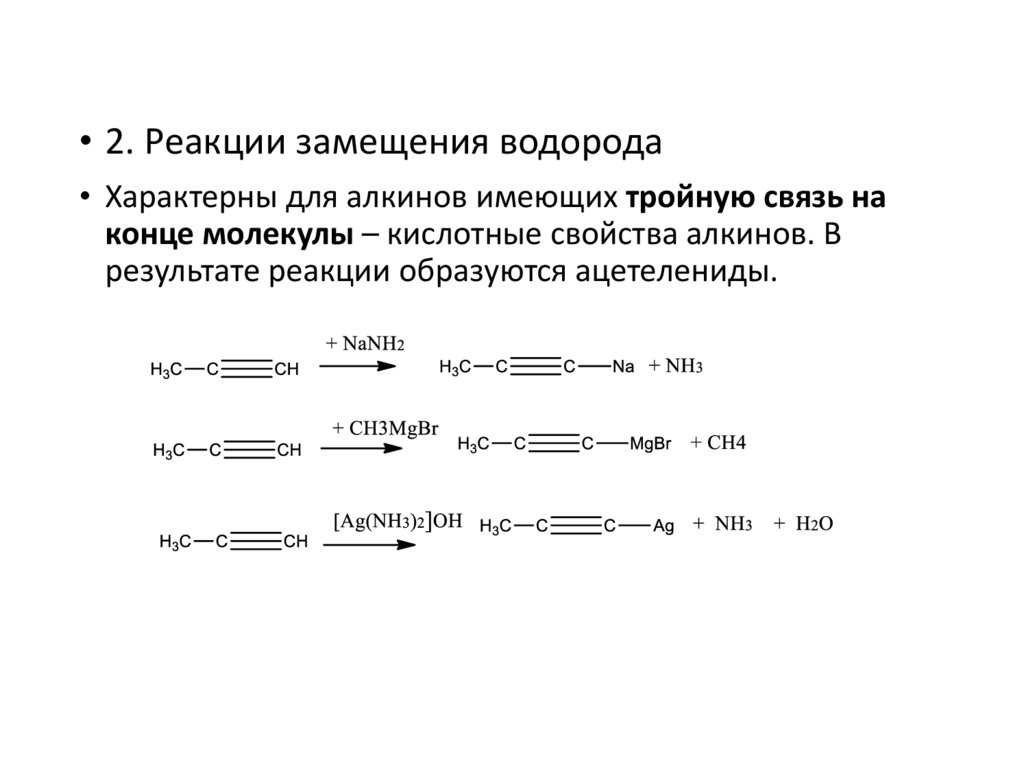
• 2. Реакции замещения водорода• Характерны для алкинов имеющих тройную связь на
конце молекулы – кислотные свойства алкинов. В
результате реакции образуются ацетелениды.
26.
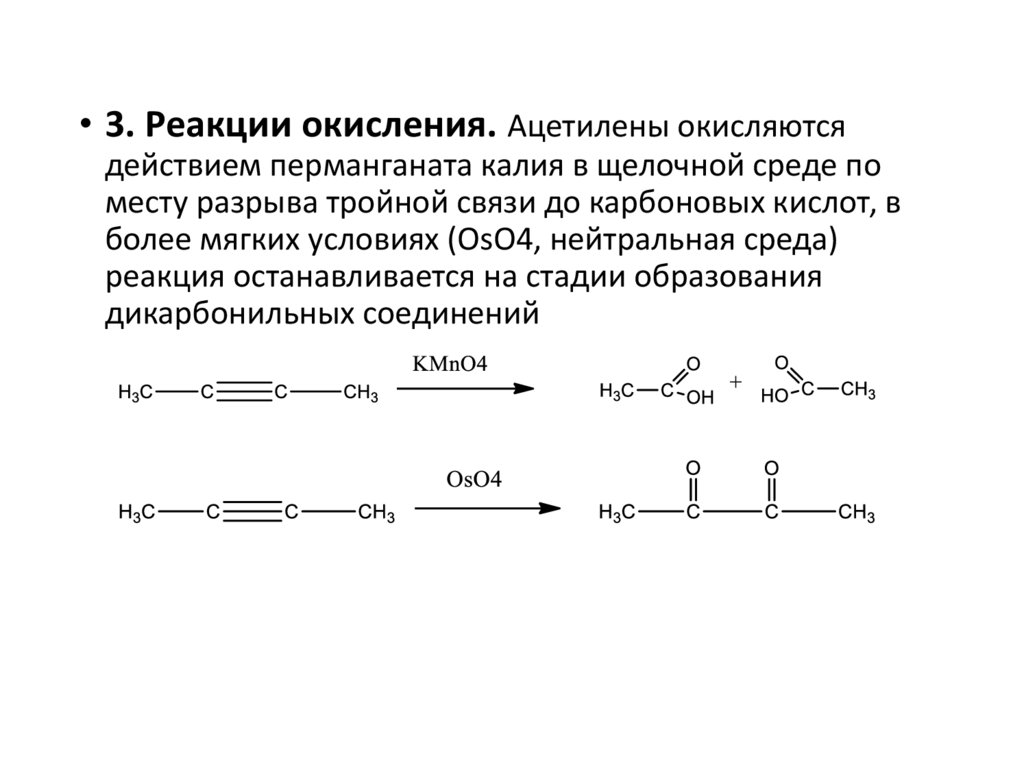
• 3. Реакции окисления. Ацетилены окисляютсядействием перманганата калия в щелочной среде по
месту разрыва тройной связи до карбоновых кислот, в
более мягких условиях (OsO4, нейтральная среда)
реакция останавливается на стадии образования
дикарбонильных соединений
27.
• 4. Реакции ди- , поли- и цикломеризации• Димеризация
• Цикломеризация
Протекает в присутствии серной кислоты или солей хрома, кобальта,
никеля
-Реакция Зелинского-Казанского
-Тетрамеризация
• Полимеризация











 Химия
Химия








