Похожие презентации:
Альдегиды и кетоны
1. АЛЬДЕГИДЫ И КЕТОНЫ
2. Физические свойства альдегидов
С1– газ с резким запахом
С2 – С3 – жидкости с резким запахом
С4 – С6 – жидкости с неприятным запахом
>С6 – высшие (особенно непредельные или ароматические) –
твердые, нерастворимые в воде, с цветочным запахом
НСОН - формальдегид – газ с резким удушливым
запахом, хорошо растворимый в воде, t кип. - 19,3С,
ядовит. 40% раствор формальдегида называется
формалином
СН3СОН – уксусный альдегид – жидкость с запахом
зелёного яблока, растворимая в воде, t кип. 21С
у этих альдегидов температуры кипения ниже, чем у соответствующих
спиртов
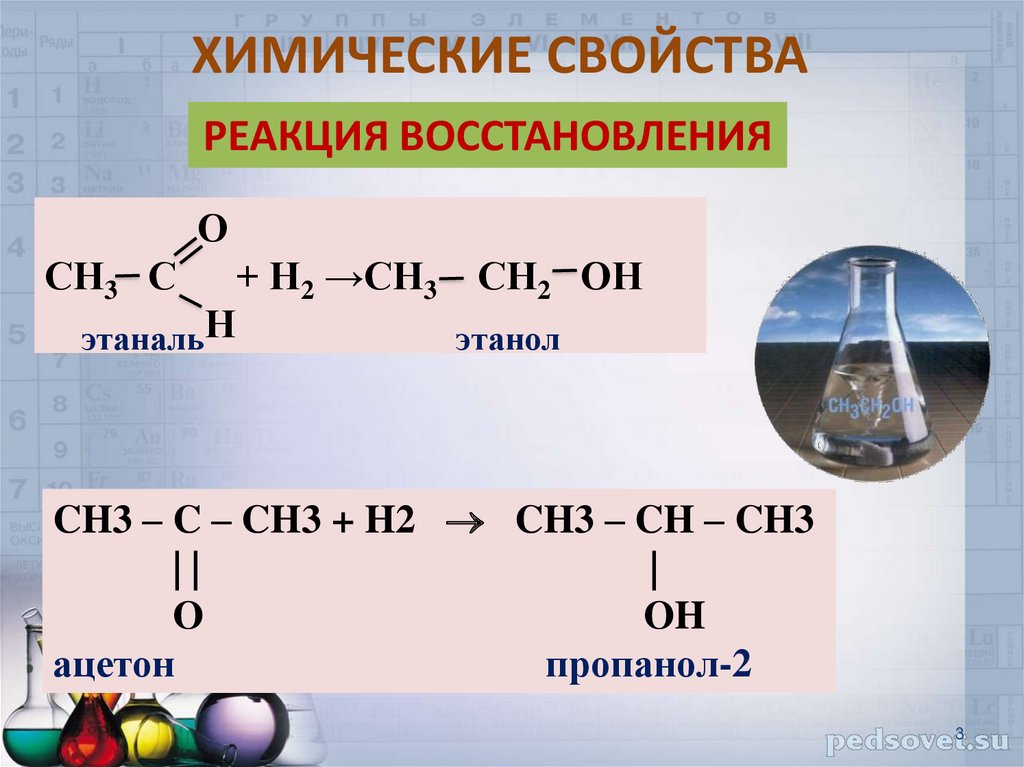
3. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИЯ ВОССТАНОВЛЕНИЯО
СН3 С
этанальН
+ Н2 →СН3
СН2 ОН
этанол
CH3 – C – CH3 + H2 CH3 – CH – CH3
||
|
O
OH
ацетон
пропанол-2
3
4.
ХИМИЧЕСКИЕ СВОЙСТВАРЕАКЦИИ ОКИСЛЕНИЯ
R – C = O + [O]
H
альдегид
→
R–C=O
OH
карбоновая кислота
О
Н-С + К2Сr2O7 + H2SO4→CO2 + Cr2(SO4)3 + K2SO4 + H2O
Н
НСООН
СН3СООН -
метановая (муравьиная) кислота
этановая (уксусная) кислота
5. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯРеакция серебряного зеркалакачественная реакция
О
СН3 С
+ 2[Ag(NH3)2]OH → СН3 С
Н
СН3 С
О
+ 2[Ag(NH3)2]OH → СН3 С
Н
О
+ 2Ag + 4NH3 + H2O
OН
О
+ 2Ag + 3NH3 + H2O
ONH4
5
6. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯРеакция с гидроксидом меди(II)
качественная реакция
О
СН3 С
этаналь
+ 2Cu(OH)2 → СН3 С
Н
этановая кислота
О
+ 2H2O + Cu2O
OН
оксид
меди (I)
(кирпично-красный)
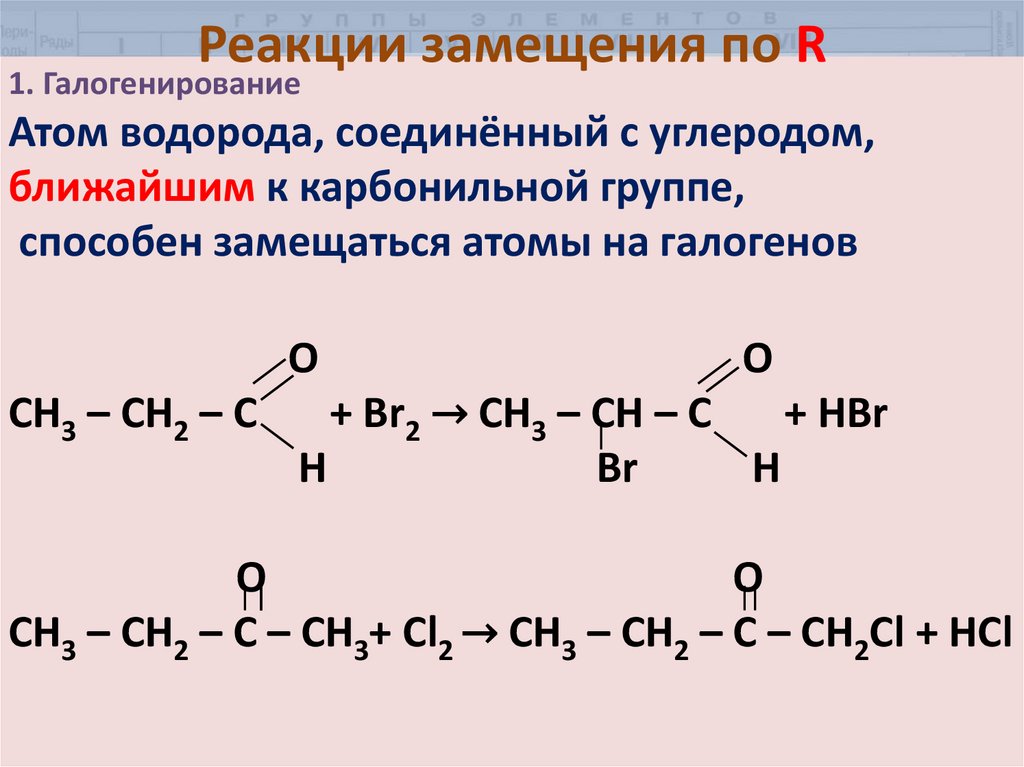
7. Реакции замещения по R
1. ГалогенированиеАтом водорода, соединённый с углеродом,
ближайшим к карбонильной группе,
способен замещаться атомы на галогенов
О
CH3 – CH2 – C
O
+ Br2 → CH3 – CH – C
+ HBr
Н
Br
H
O
О
CH3 – CH2 – C – CH3+ Cl2 → CH3 – CH2 – C – CH2Cl + HCl
8. СПОСОБЫ ПОЛУЧЕНИЯ
1. ДЕГИДРИРОВАНИЕ СПИРТОВO
Cu,t
//
CH3 – CH2 – CH2 – OH СH3 – CH2 – C
+ H2
\
H
Cu,t
СH3 – CH – CH3 CH3 – C – CH3 + H2
|
||
OH
O
пропанон - 2 (ацетон)
8
9. СПОСОБЫ ПОЛУЧЕНИЯ 2. ОКИСЛЕНИЕ СПИРТОВ Составьте уравнение окисления CuO этилового спирта(см. химические свойства спиртов)
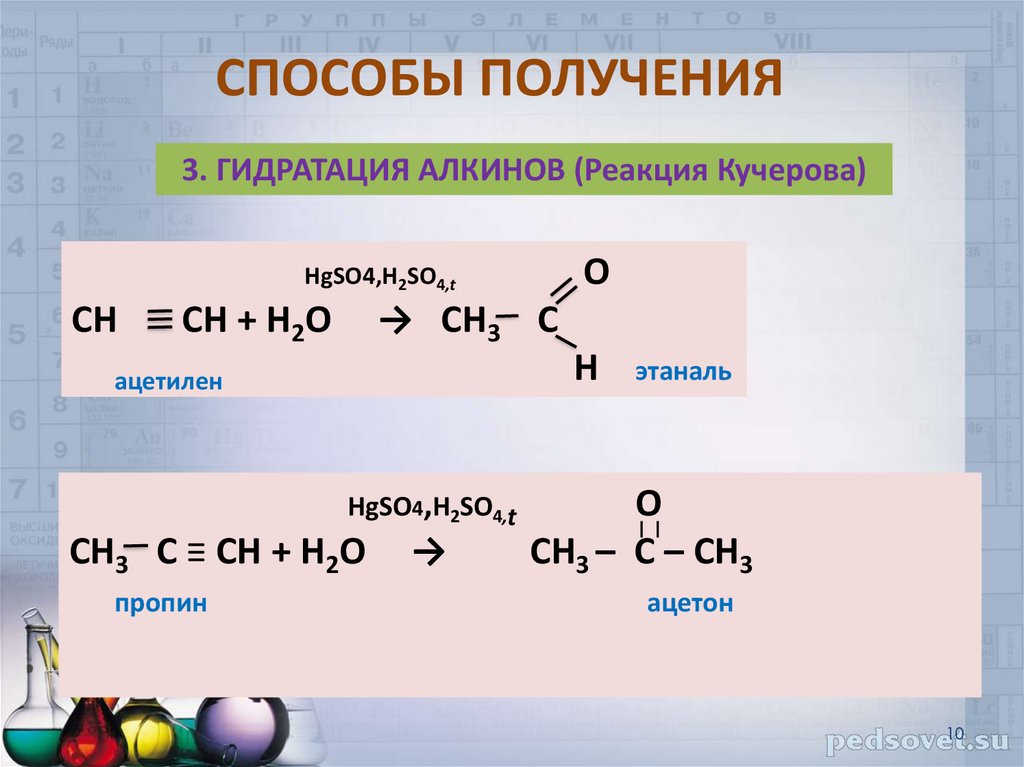
10. СПОСОБЫ ПОЛУЧЕНИЯ
3. ГИДРАТАЦИЯ АЛКИНОВ (Реакция Кучерова)О
HgSO4,H2SO4,t
СН
СН + Н2О
→ СН3 С
Н
ацетилен
HgSO4,H2SO4,t
СН3 С ≡ СН + Н2О
пропин
→
этаналь
O
СН3 – С – СН3
ацетон
10
11. Применение альдегидов
Производстволекарств
В сельском хозяйстве
для протравливания
семян
Производство серной
кислоты
В строительстве
Производство пластмасс
В кожевенной промышленности
Для дубления кожи
12. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПАРФЮМЕРИЯ• Альдегид анисовый,
обепин – жидкость с
приятным запахом мимозы
• Альдегид дециловый,
деканаль – при
разбавлении появляются
нотки запаха апельсиновой
корки
13. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПОЛИМЕРНЫЕ МАТЕРИАЛЫФенолформальдегидные смолы










 Химия
Химия








