Похожие презентации:
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
1.
Окисно-відновні реакції. Процесиокиснення та відновлення,
окисники та відновники.
Хімія 9 клас
2.
Записати рівняння реакцій, вказати їх типиSO3 + H2O
Fe + HCl
N2O5 + H2O
CaO + HCl
FeO + H2SO4
Zn + H2SO4
BaO + H2O
KOH + H2SO4
Fe(OH)3
Fe + CuSO4
3.
Запишемо рівняння реакціїFe +CuSO4 = FeSO4 + Сu
4.
Fe 0+Cu+2 SO4 = Fe +2 SO4 + Сu0Fe0 - 2e = Fe+2
Відновник
Окиснення
Cu+2 + 2e = Cu0
Окисник
Відновлення
5.
Основні поняття• Окиснення — це процес віддачі електрона.
• Відновлення — процес прийому
електрона.
• Атом, що віддає електрони, називається
відновником.
• Атом, що приймає електрони,
називається окисником.
6.
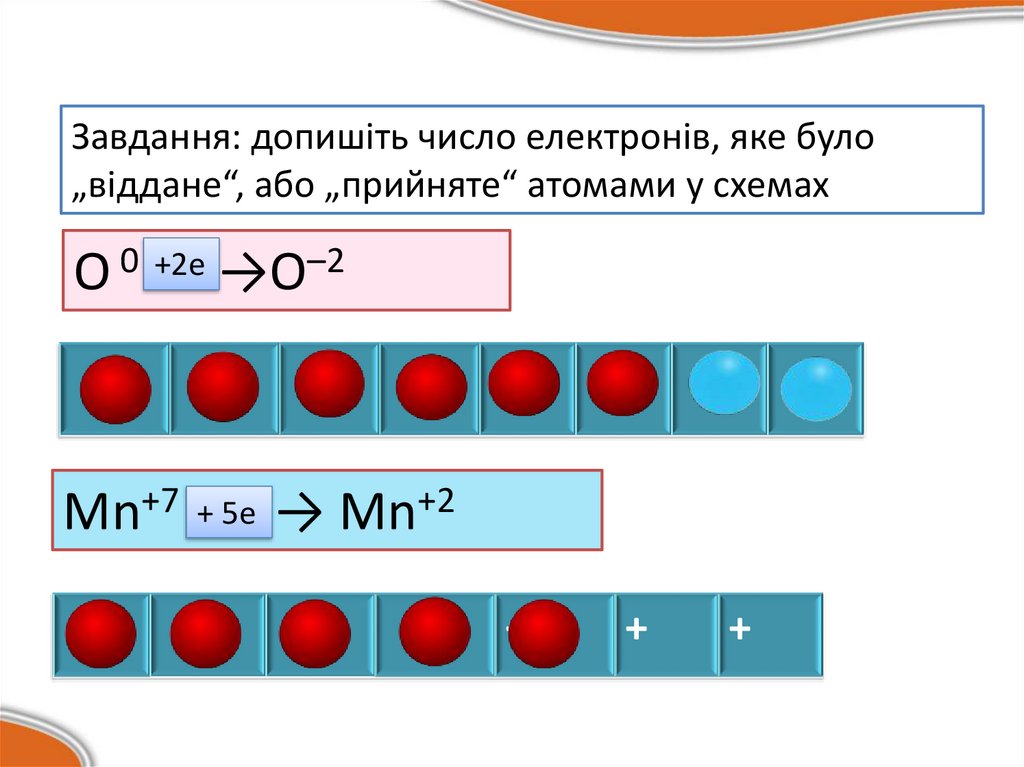
Завдання: допишіть число електронів, яке було„віддане“, або „прийняте“ атомами у схемах
–2
+2е
О 0……→О
+
+
+
+ +
+ 5e → Mn+2
Mn+7 …..
+
+
+
+
+
+
+
7.
Завдання: допишіть число електронів, яке було„віддане“, або „прийняте“ атомами у схемах
0
−2е
О–2……→О
+5
−8е
N–3……→N
0
−2е
N–2 ……→N
+6
−8е
S–2……→S
0
+2е
Ca+2……→Ca
0
+2е
Fe+2……→Fe
Доповніть схем електронних процесів
S0 + 2е →…… S–2
N0
–3
N
+3е→……
S–2
Р0
+5
Р
─5е →……
─2е→…..
S0






 Химия
Химия








