Похожие презентации:
Индол. Методы синтеза. Химические свойства. Биологически активные производные. (Лекция 4)
1.
Химия биологическиактивных веществ
Лекция 4
ИНДОЛ
1. Методы синтеза
2. Химические свойства
3. Биологически активные
производные
1
2.
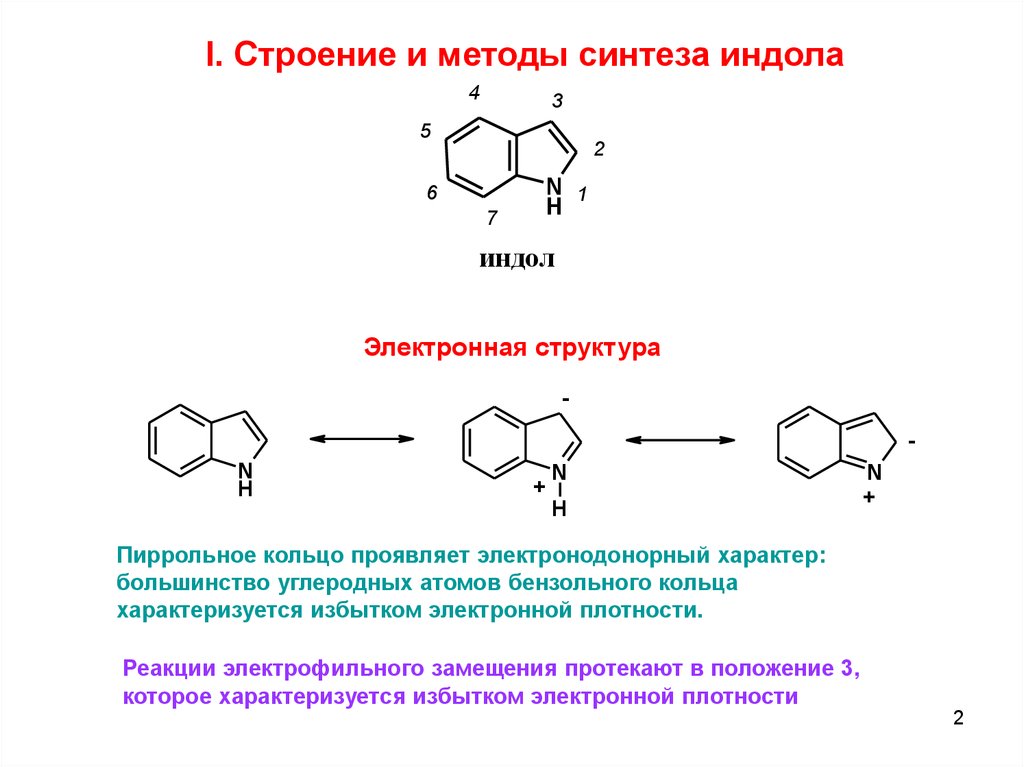
I. Cтроение и методы синтеза индола4
3
5
2
N 1
H
6
7
индол
Электронная структура
N
H
+
N
H
N
+
Пиррольное кольцо проявляет электронодонорный характер:
большинство углеродных атомов бензольного кольца
характеризуется избытком электронной плотности.
Реакции электрофильного замещения протекают в положение 3,
которое характеризуется избытком электронной плотности
2
3
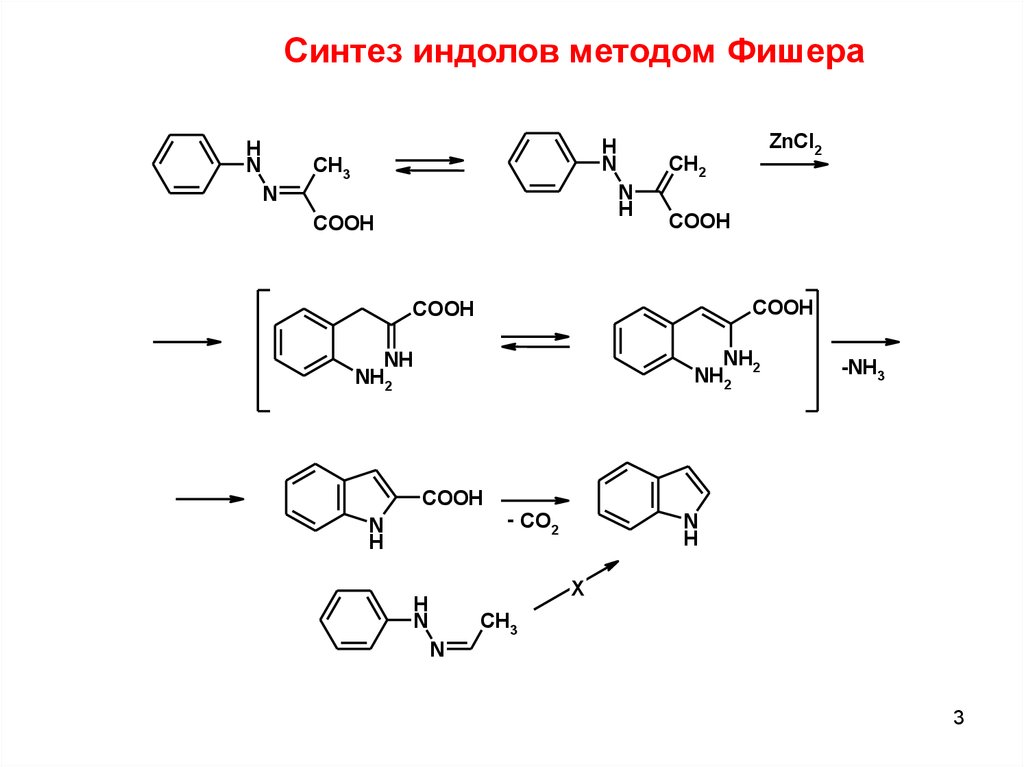
3.
Синтез индолов методом ФишераH
N
H
N
CH3
CH2
N
H
N
COOH
ZnCl2
COOH
COOH
COOH
NH2
NH2
NH
NH2
-NH3
COOH
- CO2
N
H
N
H
X
H
N
CH3
N
34
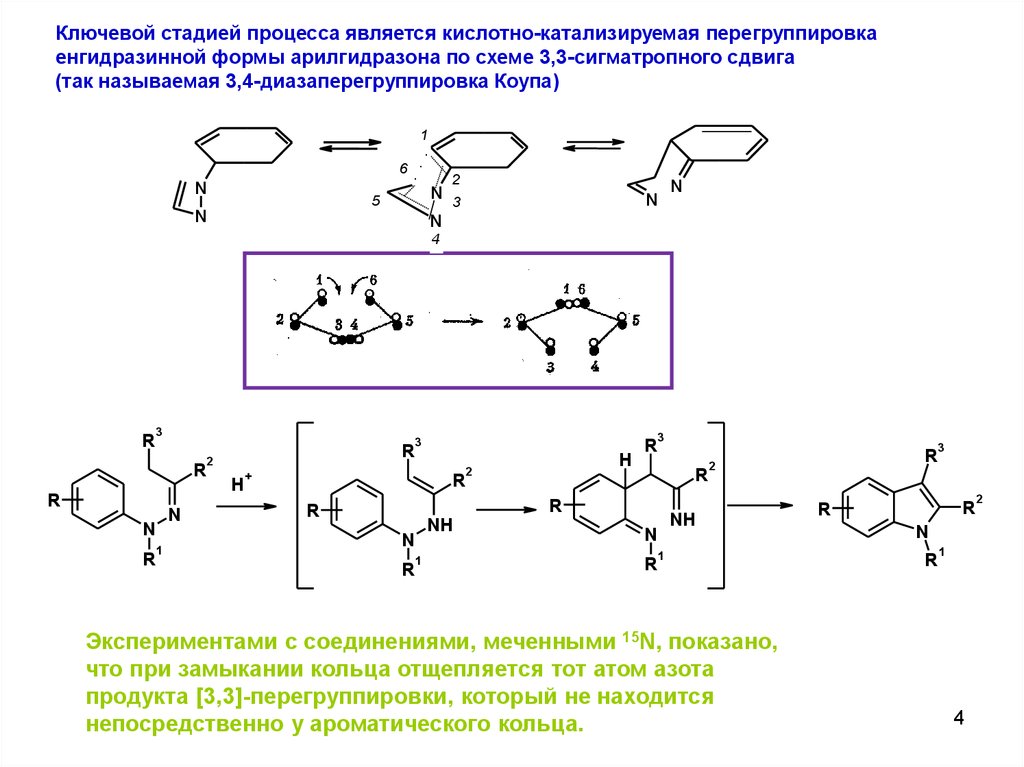
4.
Ключевой стадией процесса является кислотно-катализируемая перегруппировкаенгидразинной формы арилгидразона по схеме 3,3-сигматропного сдвига
(так называемая 3,4-диазаперегруппировка Коупа)
1
6
N
.
.
.
2
N 3
N
5
N
N
N
4
R
3
R
R
N
N
R
1
R
2
H
3
+
R
H
2
R
3
R
R
R
NH
N
R
1
NH
N
R
R
2
1
Экспериментами с соединениями, меченными 15N, показано,
что при замыкании кольца отщепляется тот атом азота
продукта [3,3]-перегруппировки, который не находится
непосредственно у ароматического кольца.
3
R
R
N
R
1
4
2
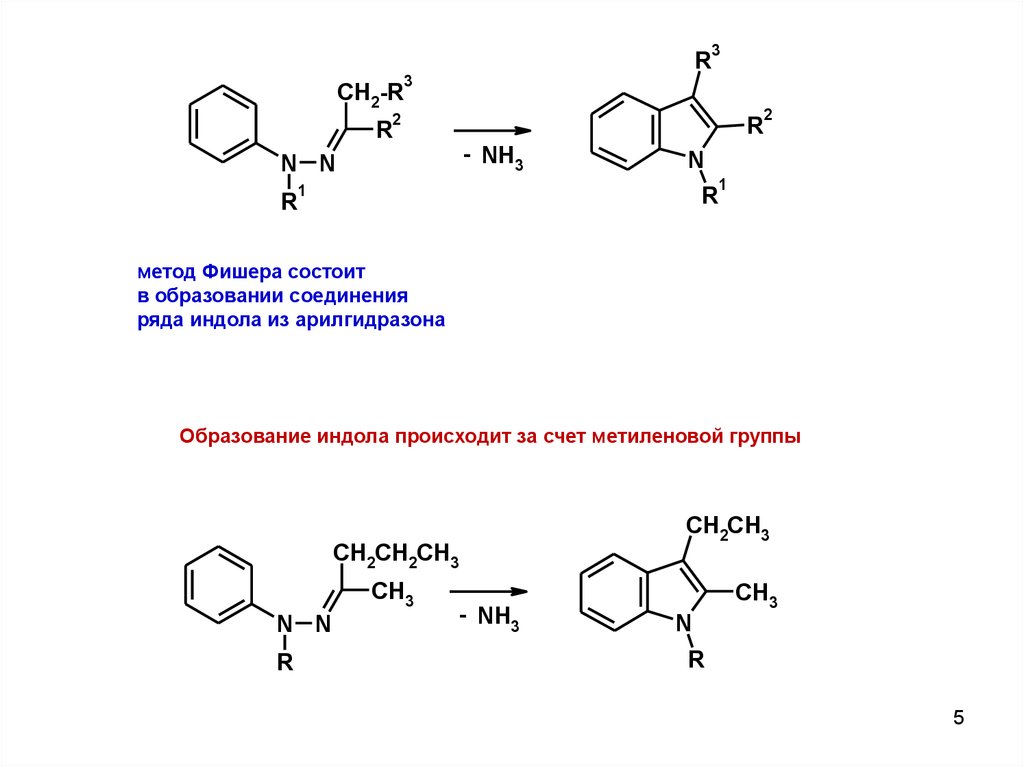
5.
RCH2-R
R
3
2
R
- NH3
N N
R
3
2
N
1
R
1
метод Фишера состоит
в образовании соединения
ряда индола из арилгидразона
Образование индола происходит за счет метиленовой группы
CH2CH3
CH2CH2CH3
CH3
N N
R
- NH3
CH3
N
R
56
6.
Синтез РейсертаЦиклизация производных 1-(2-аминофенил)пропан-2-она происходит самопроизвольно
H
O
NH
- HOH
N
Используются С-кислотные свойства метильной группы,
находящейся в орто-положении к нитрогруппе бензольного кольца.
Сначала проводят конденсацию с оксалатом,
с последующим восстановлением нитрогруппы.
CH3
NO2
CO2Et
(EtO2C)2
KOEt, EtOH,
EtOEt
H2, Pt, AcOH
OK
NO2
CO2Et
O
NH2
- HOH
CO2Et
N
H
6
8
7.
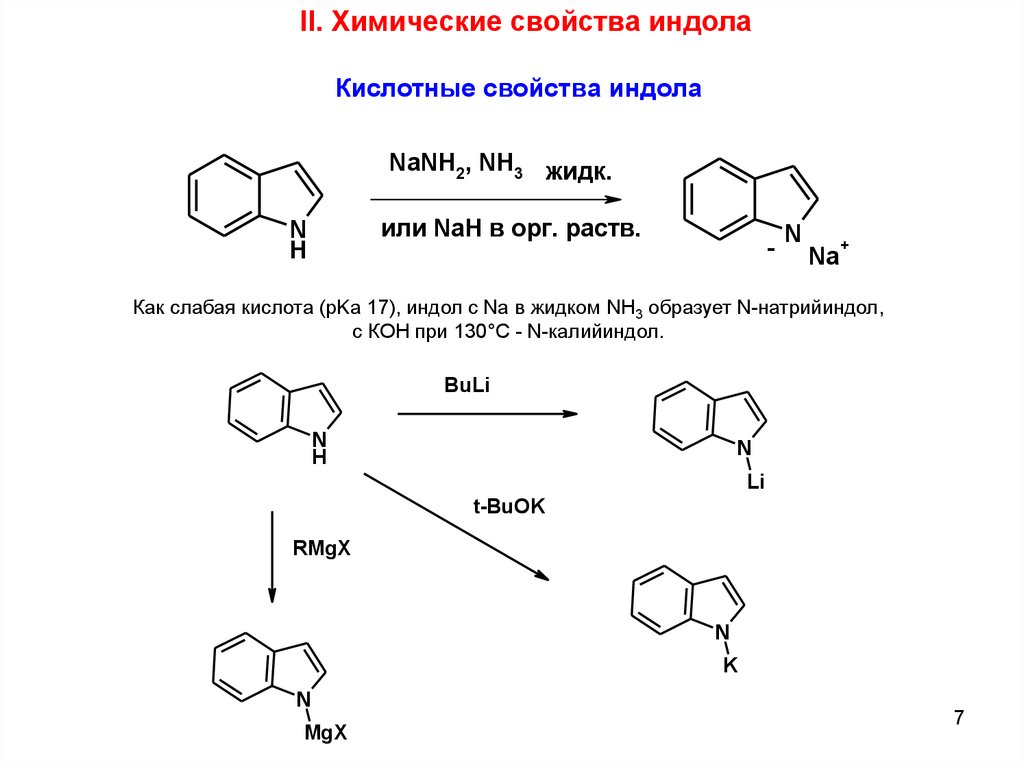
II. Химические свойства индолаКислотные свойства индола
NaNH2, NH3 жидк.
или NaH в орг. раств.
N
H
-
N
Na
+
Как слабая кислота (рKа 17), индол с Na в жидком NH3 образует N-натрийиндол,
с КОН при 130°С - N-калийиндол.
BuLi
N
H
N
Li
t-BuOK
RMgX
N
K
N
MgX
7
3
8.
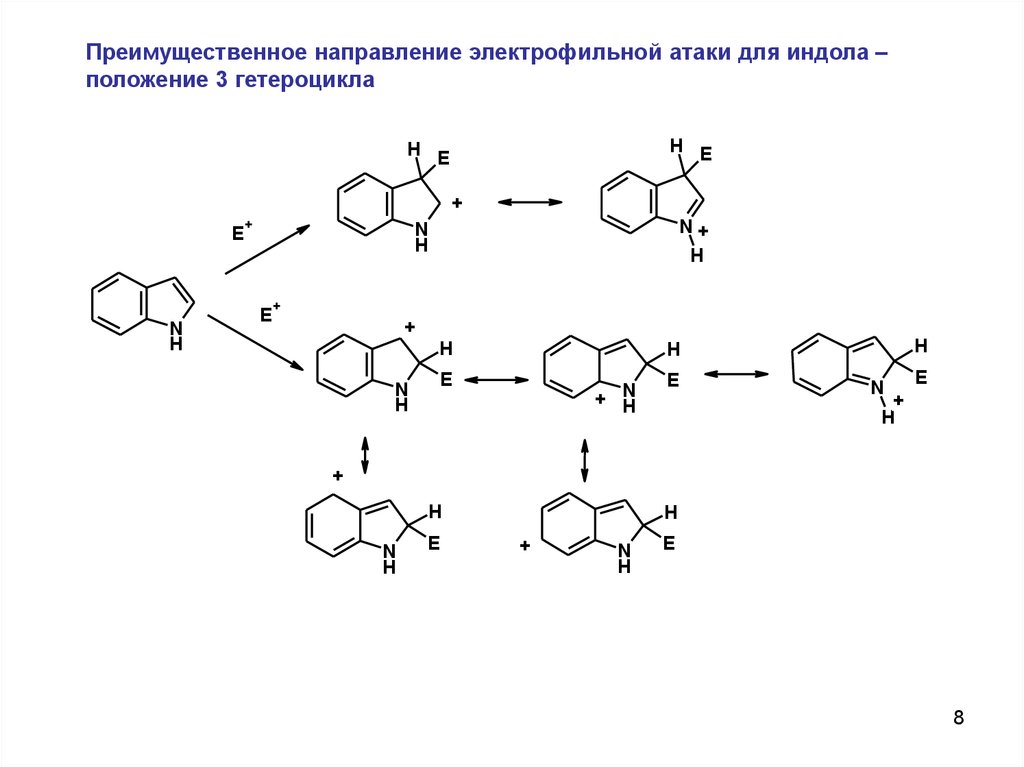
Преимущественное направление электрофильной атаки для индола –положение 3 гетероцикла
H E
H E
+
E
N
H
+
N+
N
H
E
H
+
+
H
N
H
H
H
E
+ N
H
E
N
E
+
H
+
H
N
H
E
H
+
N
H
E
8
9.
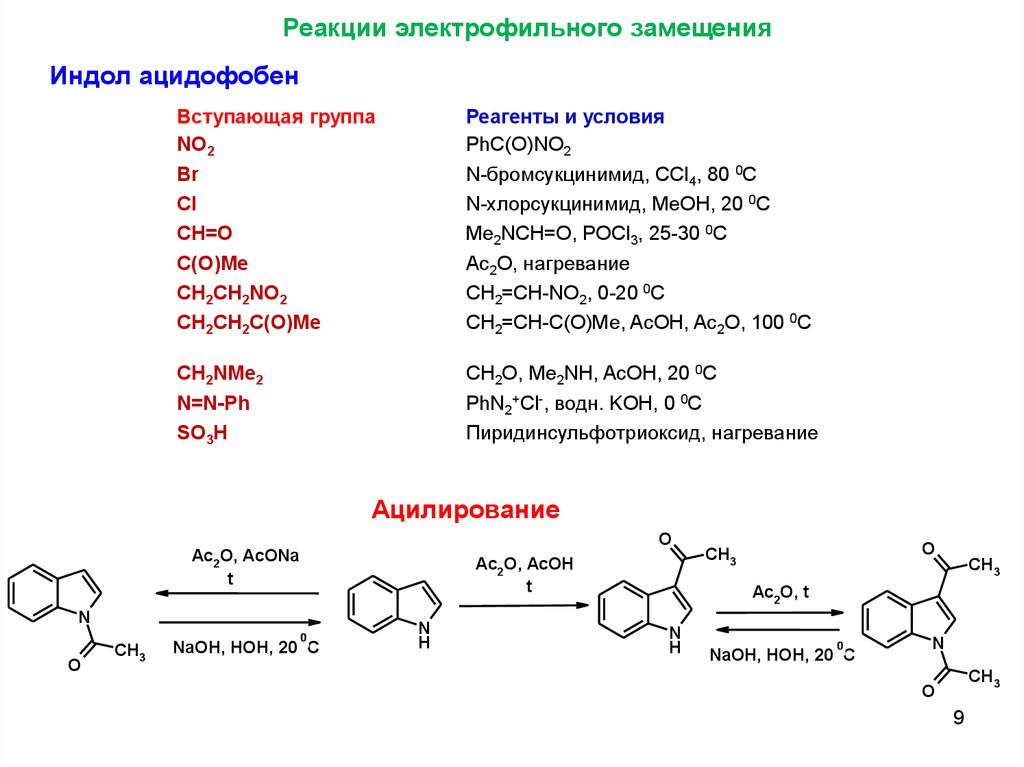
Реакции электрофильного замещенияИндол ацидофобен
Вступающая группа
NO2
Br
Cl
CH=O
C(O)Me
CH2CH2NO2
CH2CH2C(O)Me
Реагенты и условия
PhC(O)NO2
N-бромсукцинимид, ССl4, 80 0C
N-хлорсукцинимид, MeOH, 20 0C
Me2NCH=O, POCl3, 25-30 0C
Ac2O, нагревание
CH2=CH-NO2, 0-20 0C
CH2=CH-C(O)Me, AcOH, Ac2O, 100 0C
CH2NMe2
N=N-Ph
SO3H
CH2O, Me2NH, AcOH, 20 0C
PhN2+Cl-, водн. KOH, 0 0C
Пиридинсульфотриоксид, нагревание
Ацилирование
O
Ac2O, AcONa
t
Ac2O, AcOH
t
N
O
CH3
0
NaOH, HOH, 20 C
N
H
O
CH3
CH3
Ac2O, t
N
H
0
NaOH, HOH, 20 C
N
CH3
O
9
10.
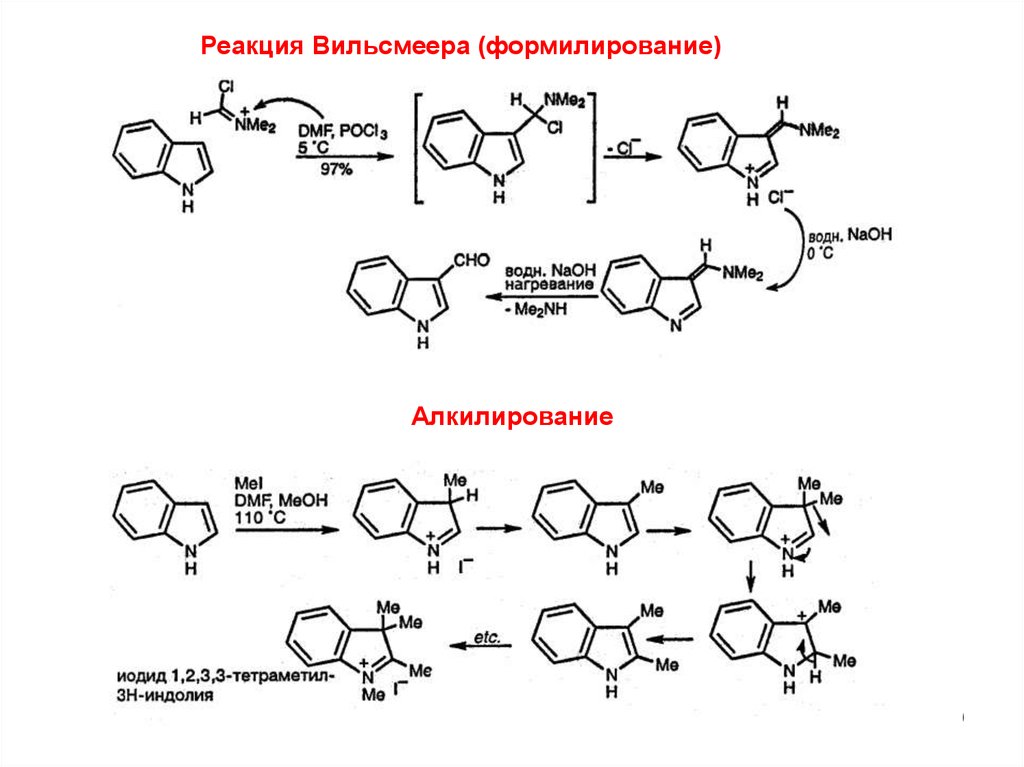
Реакция Вильсмеера (формилирование)Алкилирование
10
11.
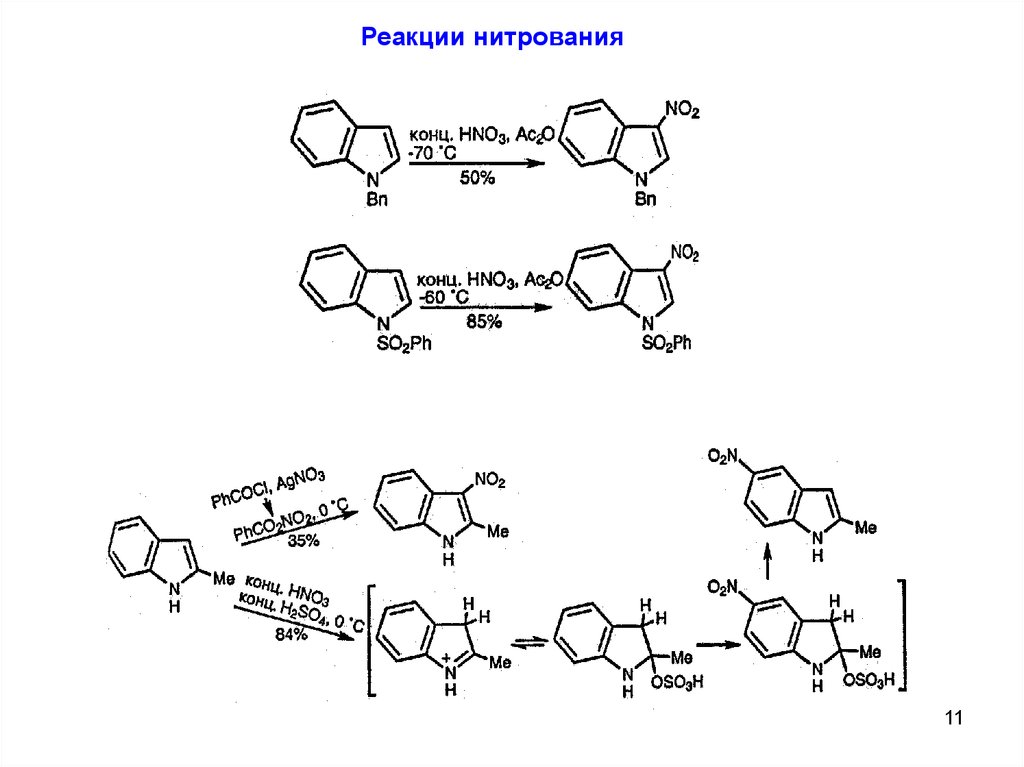
Реакции нитрования11
12.
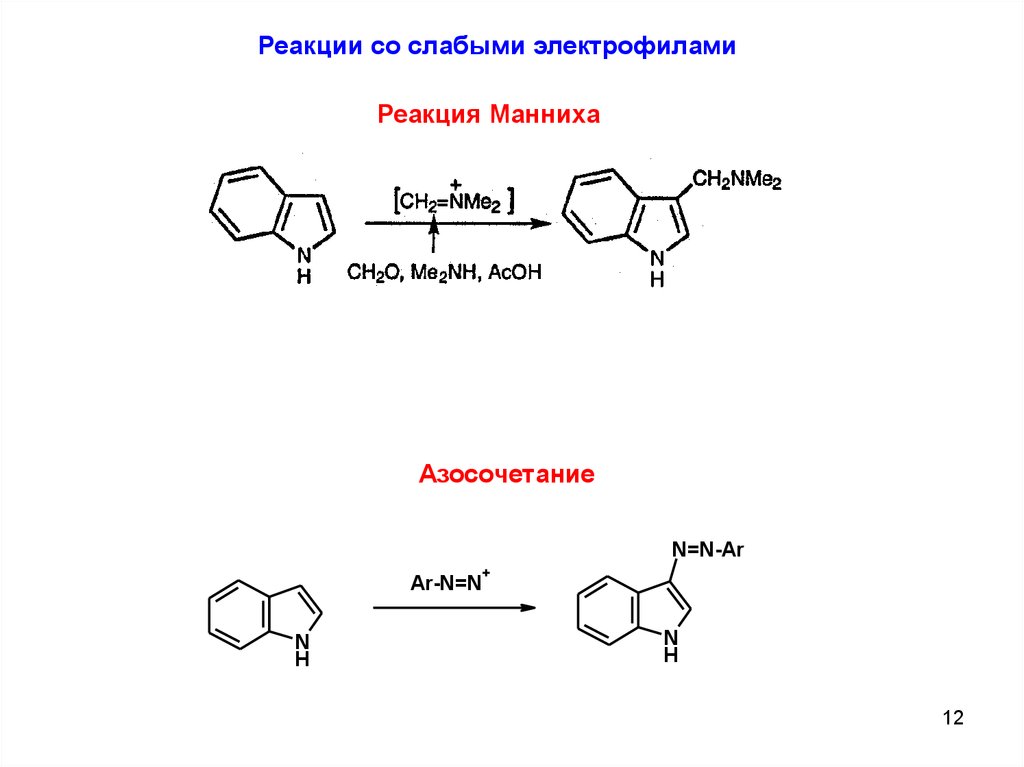
Реакции со слабыми электрофиламиРеакция Манниха
Азосочетание
N=N-Ar
Ar-N=N
N
H
+
N
H
12
13.
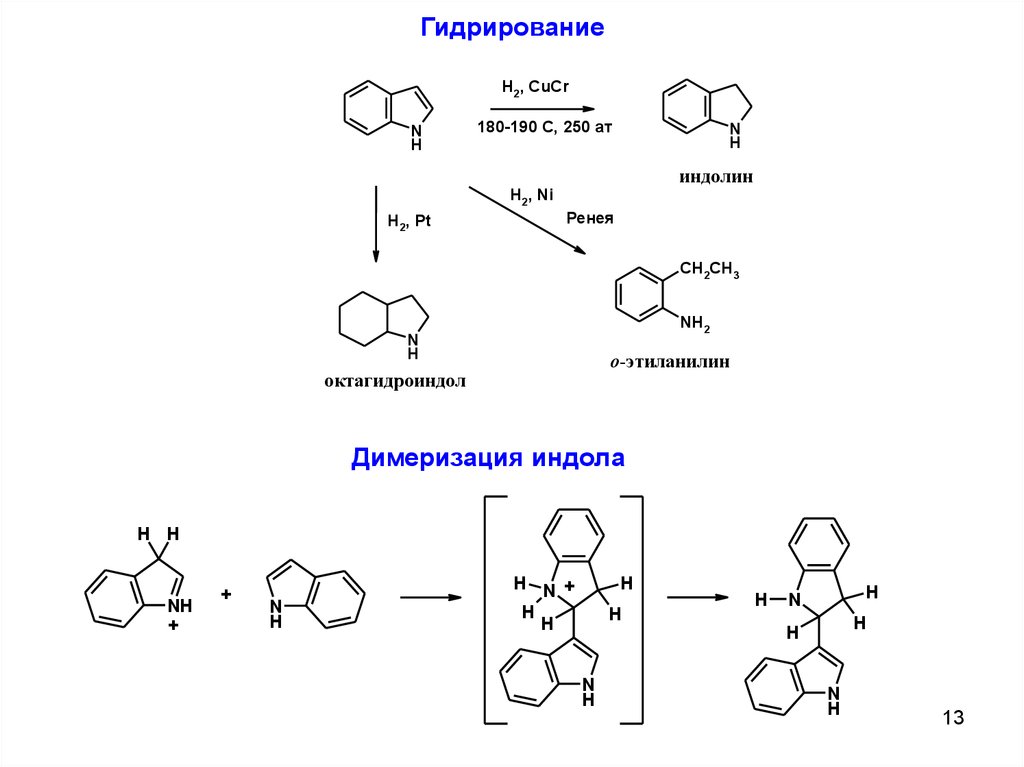
ГидрированиеH2, CuCr
N
H
180-190 C, 250 ат
N
H
индолин
H2, Ni
H2, Pt
Ренея
CH2CH3
NH2
N
H
o-этиланилин
октагидроиндол
Димеризация индола
H H
NH
+
+
N
H
H N +
H
H
H
H
H
H
N
H
H
N
H
N
H
13 4
14.
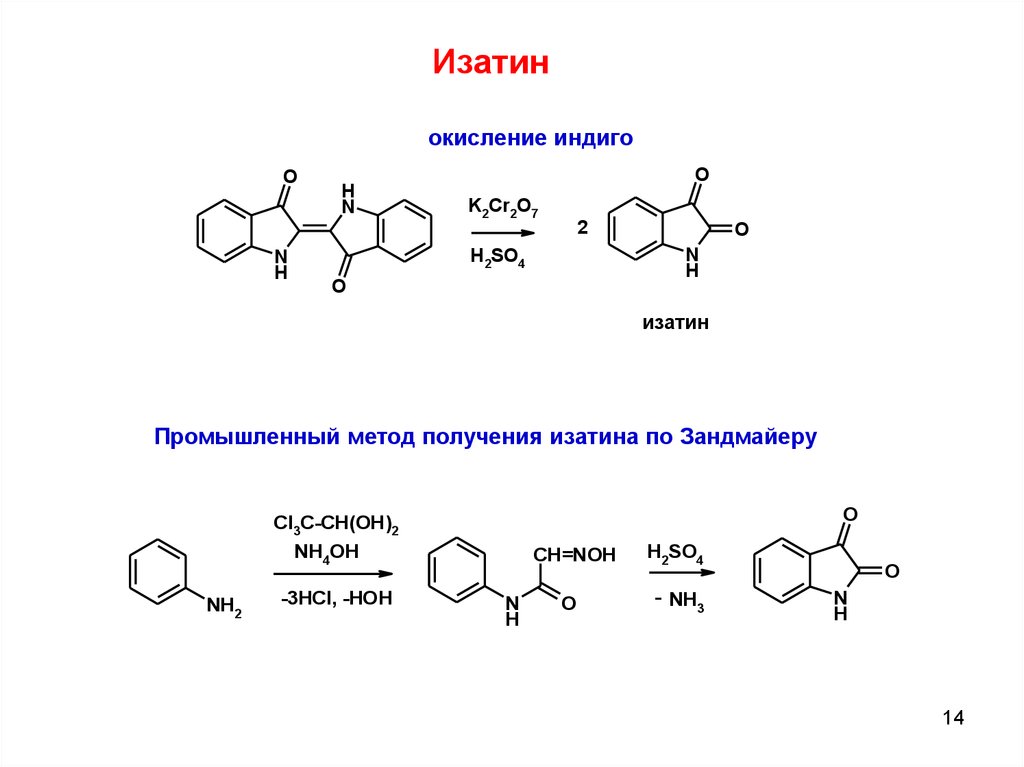
Изатинокисление индиго
O
N
H
H
N
O
K2Cr2O7
2
O
N
H
H2SO4
O
изатин
Промышленный метод получения изатина по Зандмайеру
O
Cl3C-CH(OH)2
NH4OH
NH2
-3HCl, -HOH
N
H
CH=NOH
H2SO4
O
- NH3
O
N
H
14
15.
АрбидолАрбидол (умифеновир) проявляет иммуностимулирующее действие и
подавляет вирусы гриппа А и В. Наименование «Арбидол» было
присвоено умифеновиру его разработчиком — ВНИХФИ в 1974 году,
как производное от слов «карбэтокси» и «броминдол».
CH3
H3C
N
CH3
O
O
HO
Br
N
S
CH3
Арбидол
(умифеновир)
15
16.
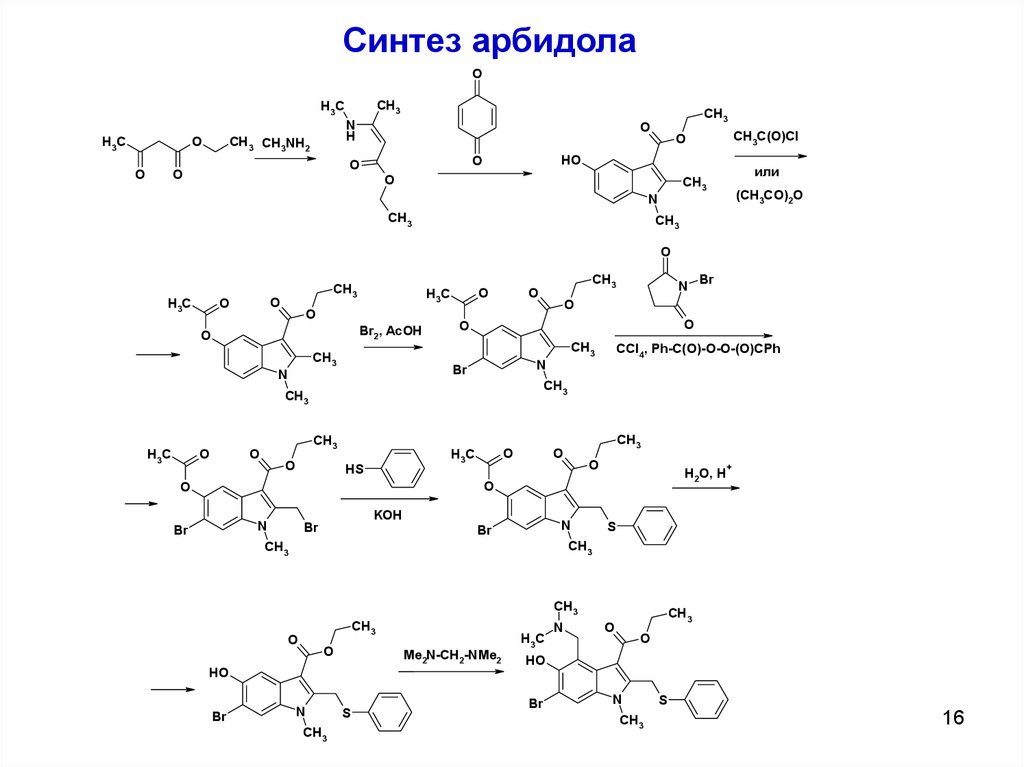
Синтез арбидолаO
CH3
H3C
H3C
CH3 CH3NH2
O
O
N
H
CH3C(O)Cl
O
HO
O
O
O
CH3
O
O
N
CH3
или
CH3
(CH3CO)2O
CH3
O
O
O
H3C
CH3
O
Br2, AcOH
O
CH3
N
O
CH3
N
CCl4, Ph-C(O)-O-O-(O)CPh
CH3
O
HS
CH3
O
O
H3C
O
H2O, H
O
O
N
Br
KOH
Br
N
Br
+
S
CH3
CH3
CH3
CH3
O
O
Me2N-CH2-NMe2
HO
Br
Br
O
Br
CH3
O
O
N
O
CH3
H3C
CH3
O
O
H3C
N
CH3
S
H3C
N
CH3
O
O
HO
Br
N
CH3
S
16
17.
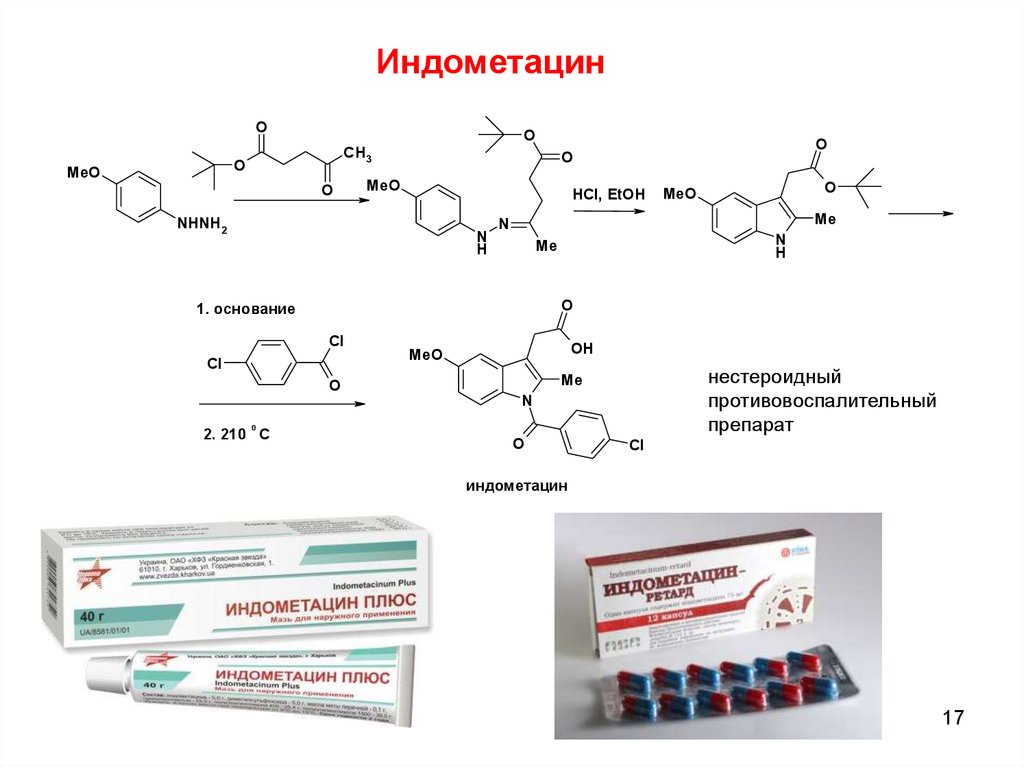
ИндометацинO
O
MeO
O
CH3
O
O
O
MeO
HCl, EtOH
NHNH2
N
H
Me
N
N
H
Me
O
1. основание
Cl
Cl
O
OH
MeO
нестероидный
противовоспалительный
препарат
Me
N
0
2. 210 С
O
MeO
O
Cl
индометацин
17
18.
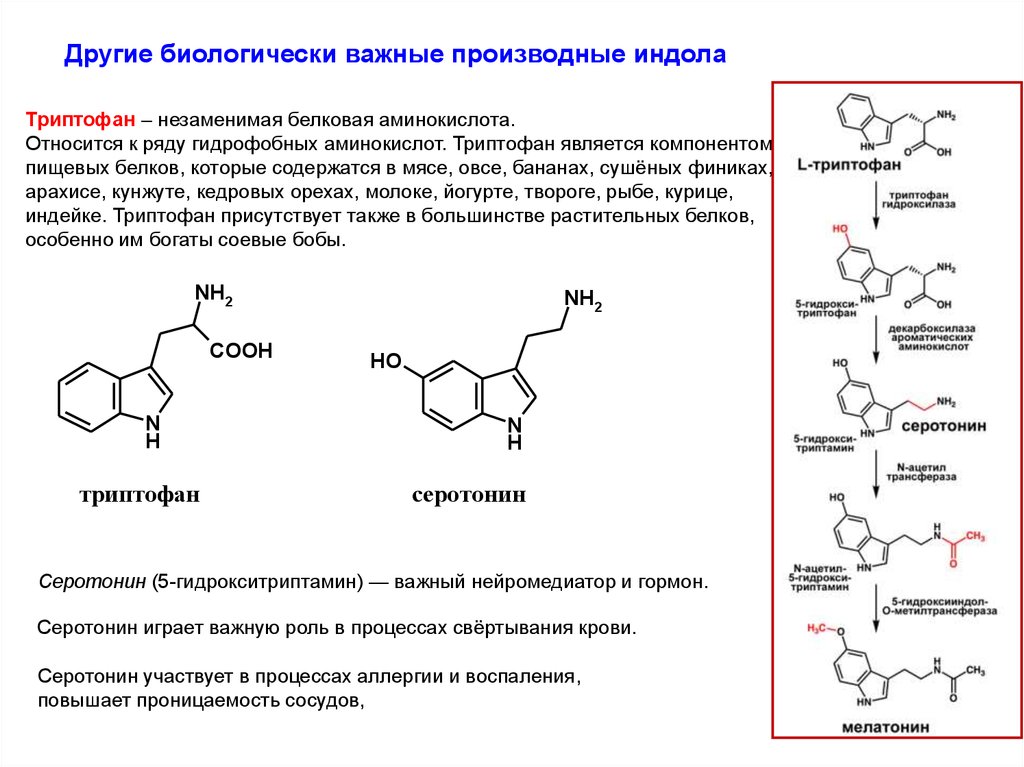
Другие биологически важные производные индолаТриптофан – незаменимая белковая аминокислота.
Относится к ряду гидрофобных аминокислот. Триптофан является компонентом
пищевых белков, которые содержатся в мясе, овсе, бананах, сушёных финиках,
арахисе, кунжуте, кедровых орехах, молоке, йогурте, твороге, рыбе, курице,
индейке. Триптофан присутствует также в большинстве растительных белков,
особенно им богаты соевые бобы.
NH2
COOH
N
H
триптофан
NH2
HO
N
H
серотонин
Серотонин (5-гидрокситриптамин) — важный нейромедиатор и гормон.
Серотонин играет важную роль в процессах свёртывания крови.
Серотонин участвует в процессах аллергии и воспаления,
повышает проницаемость сосудов,
18
19.
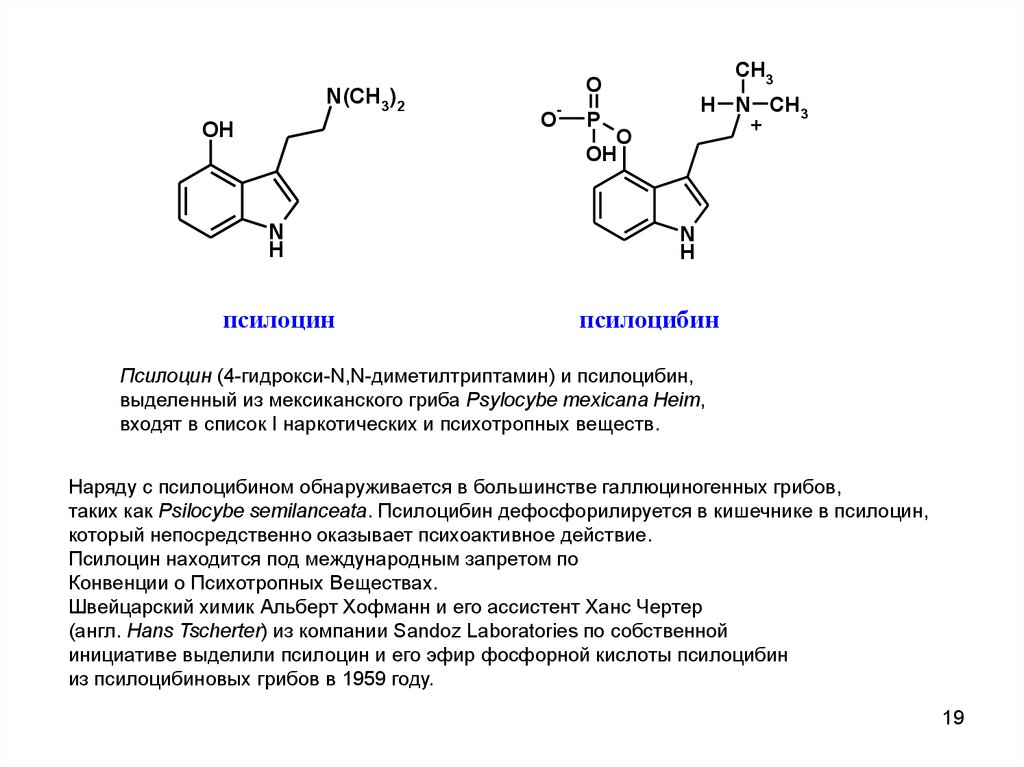
N(CH3)2OH
N
H
псилоцин
-
O
O
CH3
P
H N CH3
+
O
OH
N
H
псилоцибин
Псилоцин (4-гидрокси-N,N-диметилтриптамин) и псилоцибин,
выделенный из мексиканского гриба Psylocybe mexicana Heim,
входят в список I наркотических и психотропных веществ.
Наряду с псилоцибином обнаруживается в большинстве галлюциногенных грибов,
таких как Psilocybe semilanceata. Псилоцибин дефосфорилируется в кишечнике в псилоцин,
который непосредственно оказывает психоактивное действие.
Псилоцин находится под международным запретом по
Конвенции о Психотропных Веществах.
Швейцарский химик Альберт Хофманн и его ассистент Ханс Чертер
(англ. Hans Tscherter) из компании Sandoz Laboratories по собственной
инициативе выделили псилоцин и его эфир фосфорной кислоты псилоцибин
из псилоцибиновых грибов в 1959 году.
19
20.
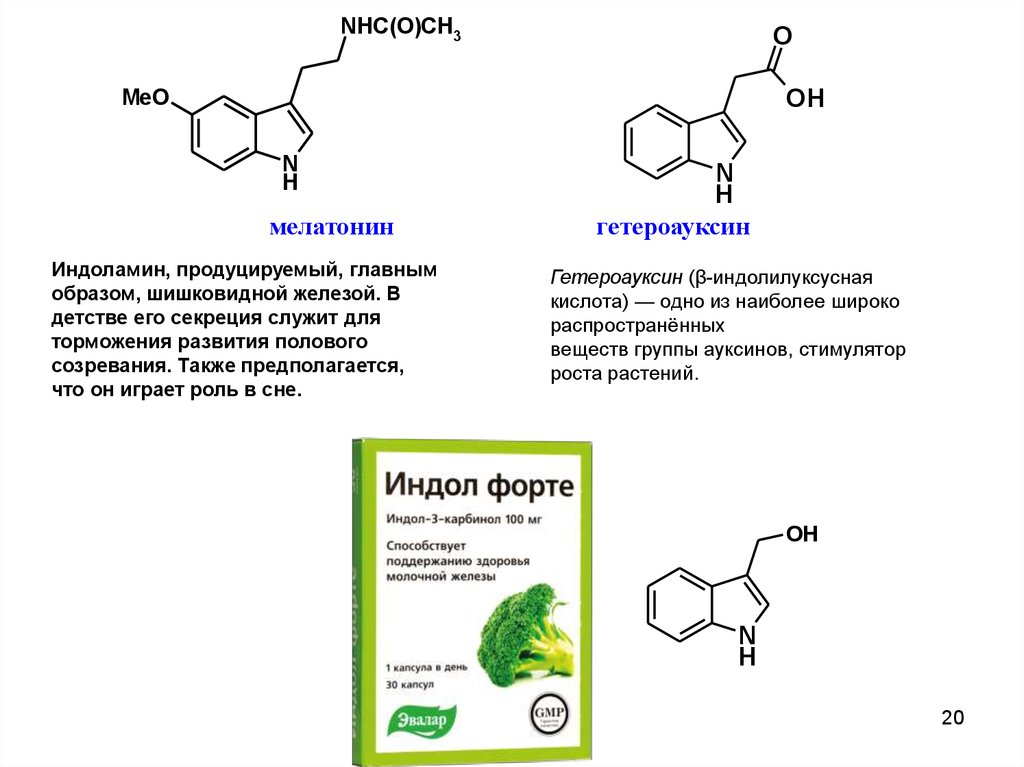
NHC(O)CH3O
OH
MeO
N
H
мелатонин
Индоламин, продуцируемый, главным
образом, шишковидной железой. В
детстве его секреция служит для
торможения развития полового
созревания. Также предполагается,
что он играет роль в сне.
N
H
гетероауксин
Гетероауксин (β-индолилуксусная
кислота) — одно из наиболее широко
распространённых
веществ группы ауксинов, стимулятор
роста растений.
OH
N
H
20
7
21.
Курс лекций является частью учебно-методического комплекса«Химия биологически активных веществ»
автор:
Носова Эмилия Владимировна, д.х.н., доцент кафедры органической химии УГТУ-УПИ
Учебно-методический комплекс подготовлен на кафедре органической химии
химико-технологического института УрФУ
Никакая часть презентации не может быть воспроизведена в
какой бы то ни было форме без письменного разрешения авторов
21 13




 Биология
Биология Химия
Химия








