Похожие презентации:
Cтроение и спектры молекул
1. Литература к курсу “Cтроение и спектры молекул”
1. Татевский В.М. Строение молекул. М. Химия. 1977.2. Пентин Ю.А., Вилков Л.В., Физические методы исследования в химии, М.,
Мир, 2006 г. (или предыдущие издания), например,
Структурные методы и оптическая спектроскопия, М., Высшая школа, 1987 г.,
Резонансные и электрооптические методы, М., Высшая школа, 1989
3. А.А.Мальцев, Молекулярная спектроскопия, М., МГУ, 1980 г.
4. Минкин В.И., Симкин Б.Я., Миняев P.M. Теория строения молекул. Ростов-наДону: "Феникс" 1997.
5. Гиллеспи Р., Харгиттаи И. Модель отталкивания электронных пар валентной
оболочки и строение молекул. М., Мир. 1992 г.
6. Краснов К.С. Молекулы и химическая связь. М. Высшая школа. 1977.
2.
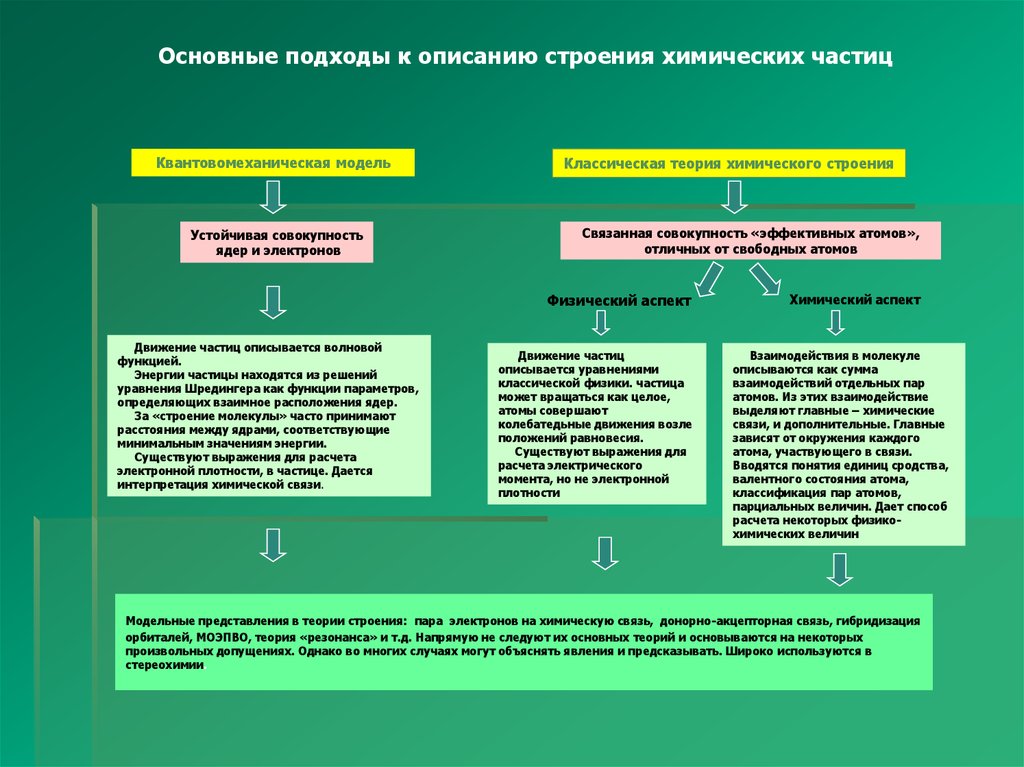
Основные подходы к описанию строения химических частицКвантовомеханическая модель
Устойчивая совокупность
ядер и электронов
Классическая теория химического строения
Связанная совокупность «эффективных атомов»,
отличных от свободных атомов
Физический аспект
Движение частиц описывается волновой
функцией.
Энергии частицы находятся из решений
уравнения Шредингера как функции параметров,
определяющих взаимное расположения ядер.
За «строение молекулы» часто принимают
расстояния между ядрами, соответствующие
минимальным значениям энергии.
Существуют выражения для расчета
электронной плотности, в частице. Дается
интерпретация химической связи.
Движение частиц
описывается уравнениями
классической физики. частица
может вращаться как целое,
атомы совершают
колебатедьные движения возле
положений равновесия.
Существуют выражения для
расчета электрического
момента, но не электронной
плотности
Химический аспект
Взаимодействия в молекуле
описываются как сумма
взаимодействий отдельных пар
атомов. Из этих взаимодействие
выделяют главные – химические
связи, и дополнительные. Главные
зависят от окружения каждого
атома, участвующего в связи.
Вводятся понятия единиц сродства,
валентного состояния атома,
классификация пар атомов,
парциальных величин. Дает способ
расчета некоторых физикохимических величин
Модельные представления в теории строения: пара электронов на химическую связь, донорно-акцепторная связь, гибридизация
орбиталей, МОЭПВО, теория «резонанса» и т.д. Напрямую не следуют их основных теорий и основываются на некоторых
произвольных допущениях. Однако во многих случаях могут объяснять явления и предсказывать. Широко используются в
стереохимии.
3. Возможные валентные состояния атомов
ГруппаII
III
IV
Валентность (q)
2
3
4
Валентное
состояние,
координация
Э
a
a 180o
a 120o
b
5
a
a
a 180o a 109o a , b ~ 120o a 180o a 180o a 120o
CH4
b
Э
a
2
b
Э
a
o
a b
a 120o a 120o a 120
o
b 90 a 109o
PH 3
NOCl
Э
C2 H 4
HCN
CO2
C6 H 6
VI
3
Э
Э
a
a
V
Э
Э
Э
a
B(CH3 )3 OB BO
BaCl2
Примеры
Э
a
a
(p)
Валентные углы
Э
Э
PCl5
Род атома: Z (заряд), q (валентность)
Тип атома: Z, q, р (распределение числа
валентности по связям)
Вид атома: Z, q, p, i (учитывается первое
окружение)
POF3
4
Э
Э
a
b
a
6
Э
a
Э
a
a 110o a , b 120o a 180o a 90o
H 2O
SOCl2
SO2
SF6
b
a
Э
a b
109
o
SO2Cl2
Э
a
a 120o
SO3
Постулат: Атомы одного вида приближенно эквивалентны в любых
молекулах.
Постулат: Если в экспериментально изученных частицах атомы
некоторых элементов встречаются с определенной валентностью и
образуют связи определенных кратностей, то могут существовать
любые частицы, содержащие такие атомы и такие связи.
4. Возможные пары связанных атомов
Пара любых связанныхатома:
(Э Z1
Э Z 2 )
Z1
Z2
(
Э
Э
)u
С указанием кратности связи:
Род пары:
Тип пары:
(Э Z1 ,q1
Э Z 2 ,q2 )u
(Э
Z1 , q1 , p1
Э
Z 2 , q 2 , p2
C–H, r~1.09 Å
C–Cl, r~1.7 Å
N–H, r~1.02 Å
C–C, r~1.5 Å
C=C, r~1.3 Å
C C, r~1.2 Å
Для некоторых типов связей С–С кратности u=1
C
C
)u
C
r~1.54 Å
C
r~1.51 Å
C
Вид пары (учитывается первое окружение каждого атома):( Эi
C
Z1 , q1 , p1
Э j
Z 2 , q2 , p2
Пары атомов одного вида приближенно эквивалентны в любых молекулах.
)u
5. СТЕРЕОХИМИЯ - отрасль химии, исследующая пространственное строение молекул и его влияние на физические и химические свойства.
СТЕРЕОХИМИЯ - отрасль химии, исследующая пространственное.
строение молекул и его влияние на физические и химические свойства
1. Статическая или конфигурационная стереохимия (конфигурации,
конформации, хиральность)
2. Конформационный анализ (поворотные изомеры)
3. Динамическая стереохимия (таутомерия, псевдовращение)
4. Теоретическая стереохимия (аппарат квантовой химии, теории групп и
т.д.)
5. Экспериментальные методы (ИК-, КР-, ЯМР- и т.д)
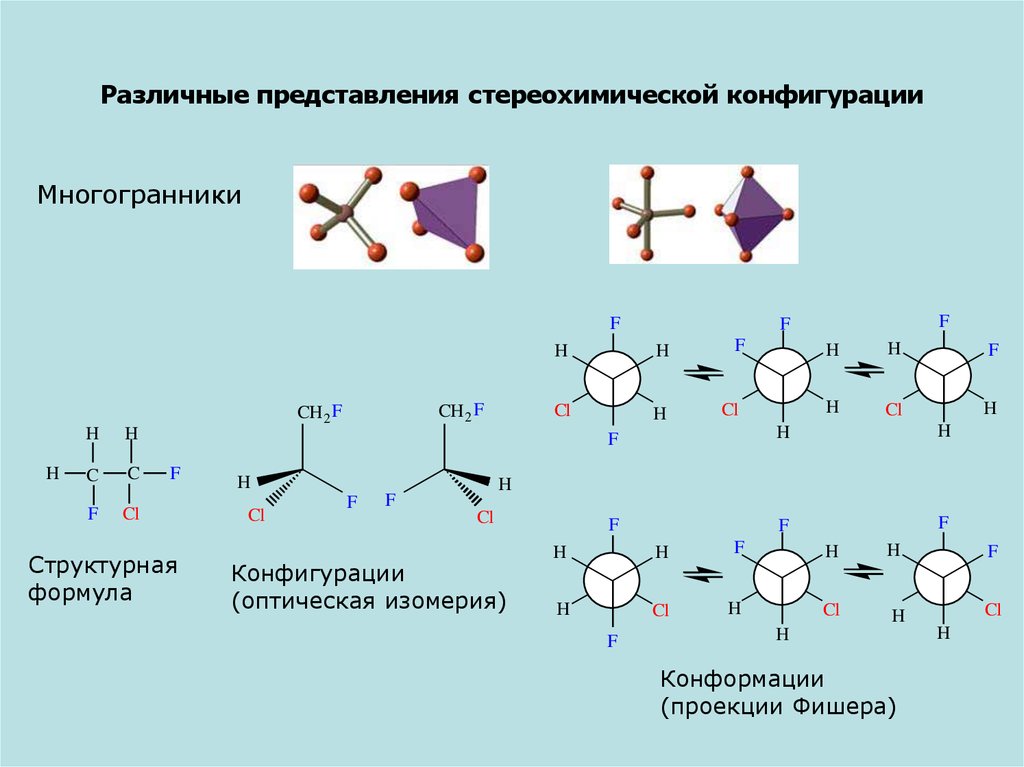
6. Различные представления стереохимической конфигурации
МногогранникиF
CH 2 F
CH 2 F
H
H
H
C
C
F
F
Cl
Структурная
формула
H
Cl
F
F
F
H
H
Cl
H
F
Cl
H
H
F
H
Cl
H
F
H
H
F
F
F
H
F
Cl
Конфигурации
(оптическая изомерия)
H
H
F
H
H
F
H
Cl
H
Cl
H
Cl
F
H
Конформации
(проекции Фишера)
H
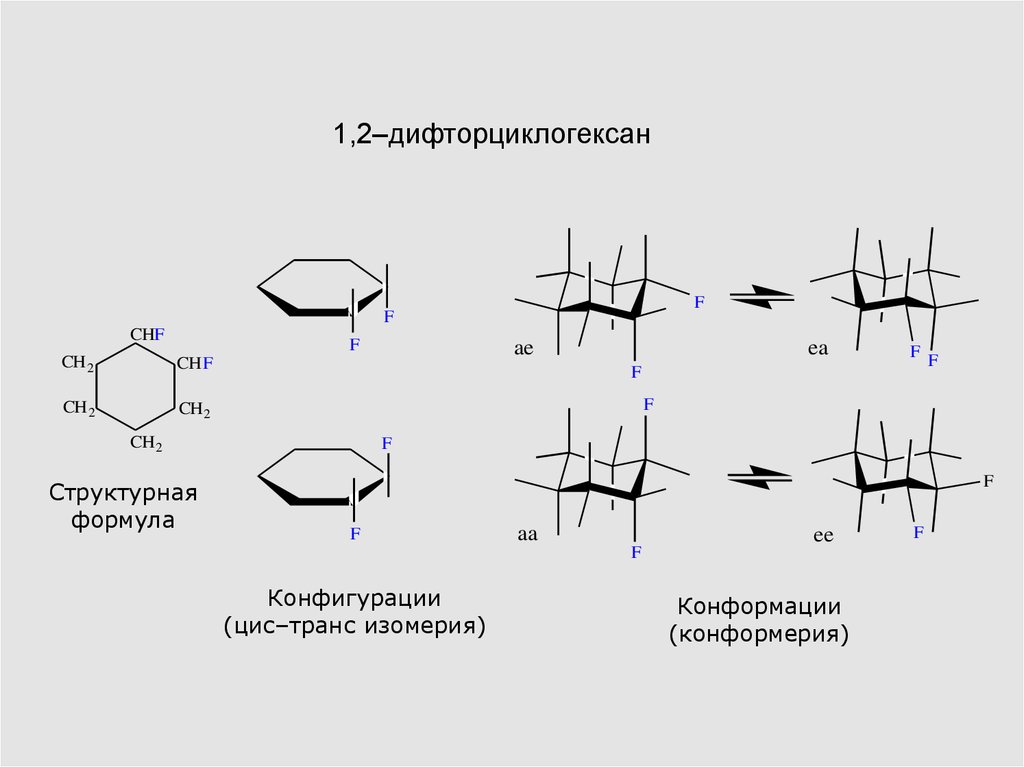
7. 1,2–дифторциклогексан
FF
CHF
F
CH 2
CH F
CH 2
CH 2
ea
F
F
F
F
CH 2
Структурная
формула
ae
F
F
F
aa
F
Конфигурации
(цис–транс изомерия)
ee
Конформации
(конформерия)
F
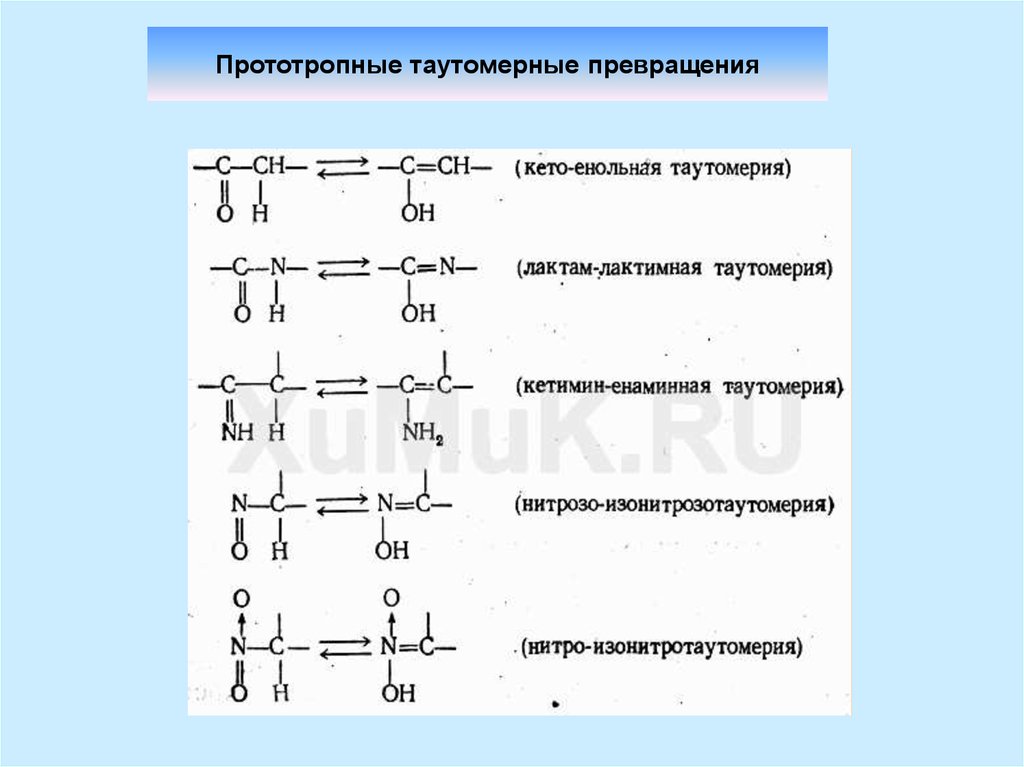
8. Прототропные таутомерные превращения
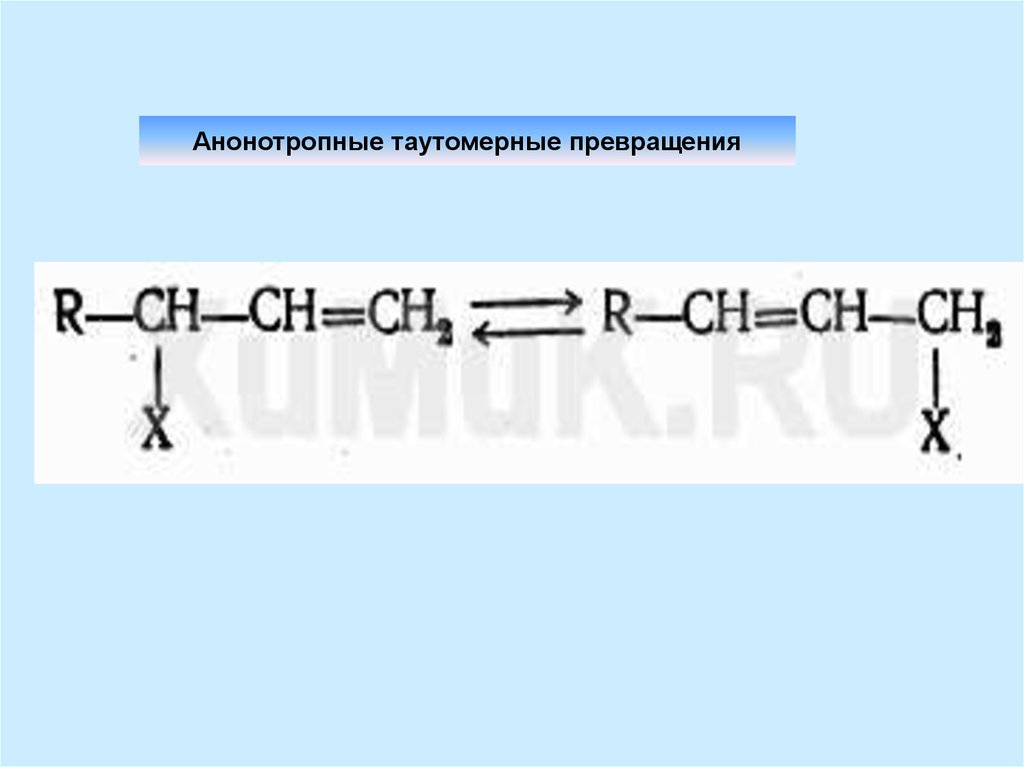
9. Анонотропные таутомерные превращения
10. Псевдовращение Берри
34
1
1
4
2
3
5
5
2
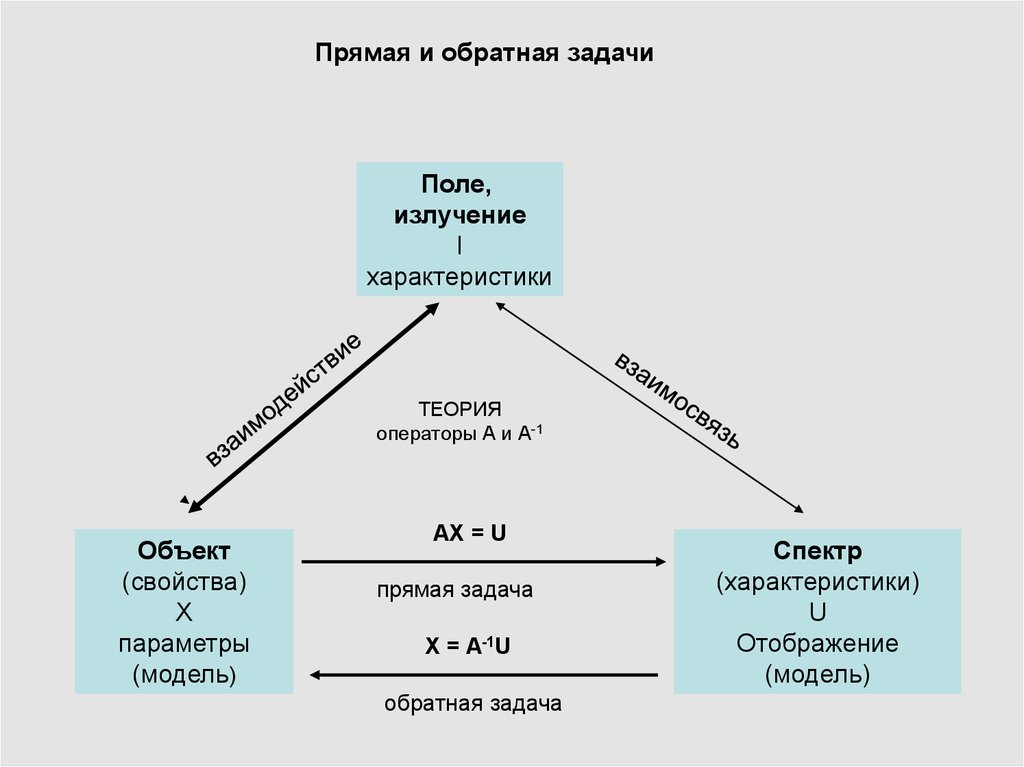
11.
Прямая и обратная задачиПоле,
излучение
I
характеристики
ТЕОРИЯ
операторы А и А-1
Объект
(свойства)
X
параметры
(модель)
АХ = U
прямая задача
X = A-1U
обратная задача
Спектр
(характеристики)
U
Отображение
(модель)
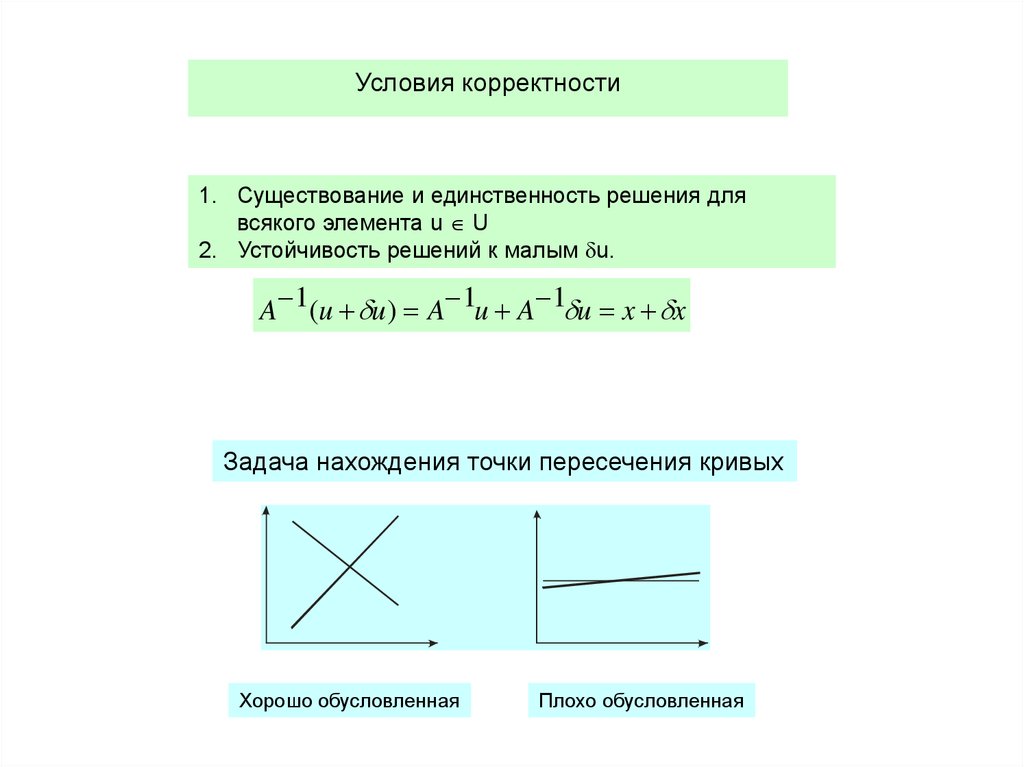
12. Условия корректности
1. Существование и единственность решения длявсякого элемента u U
2. Устойчивость решений к малым u.
A 1(u u ) A 1u A 1 u x x
Задача нахождения точки пересечения кривых
Хорошо обусловленная
Плохо обусловленная





 Химия
Химия








