Похожие презентации:
Реакционная способность карбонильных соединений. Альдегиды и кетоны
1.
Мы учим и лечимс 1888 года
Реакционная способность карбонильных
соединений
Альдегиды и кетоны
Чешкова Т.
Доцент кафедры
химии,к.х.н.
2.
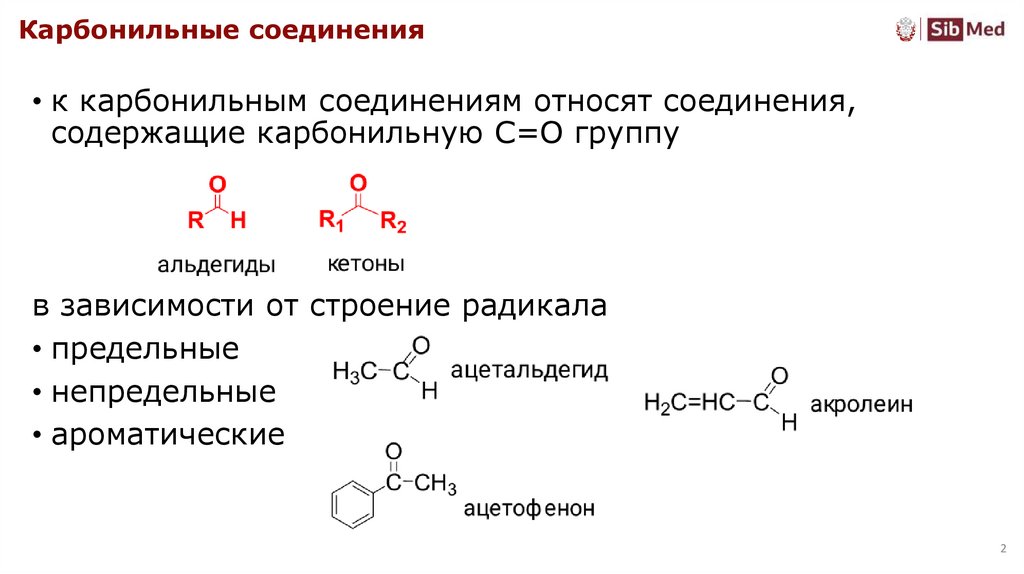
Карбонильные соединения• к карбонильным соединениям относят соединения,
содержащие карбонильную С=О группу
в зависимости от строение радикала
• предельные
• непредельные
• ароматические
2
3.
Карбонильные соединенияФизические свойства
• полярные соединения
• простейшие представители хорошо растворяются в воде
Муравьиный альдегид (метаналь) – газ, следующие члены
гомологического
ряда
–
жидкости,
температура
кипения
которых возрастает с ростом молекулярной массы. Высшие
альдегиды – твердые вещества. Муравьиный и уксусный
альдегиды хорошо растворимы в воде, с увеличением длины
углеводородного
радикала
растворимость
в
воде
уменьшается. Первый член ряда кетонов – ацетон (пропанон)
представляет собой жидкость с характерным запахом, хорошо
смешивающуюся с водой.
3
4.
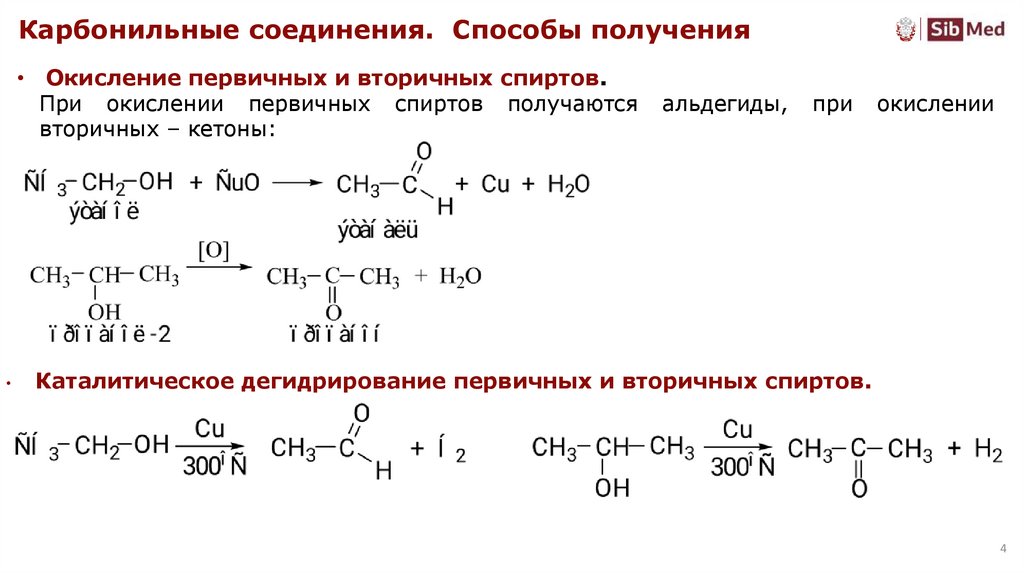
Карбонильные соединения. Способы получения• Окисление первичных и вторичных спиртов.
При окислении первичных спиртов получаются
вторичных – кетоны:
альдегиды,
при
окислении
Каталитическое дегидрирование первичных и вторичных спиртов.
4
5.
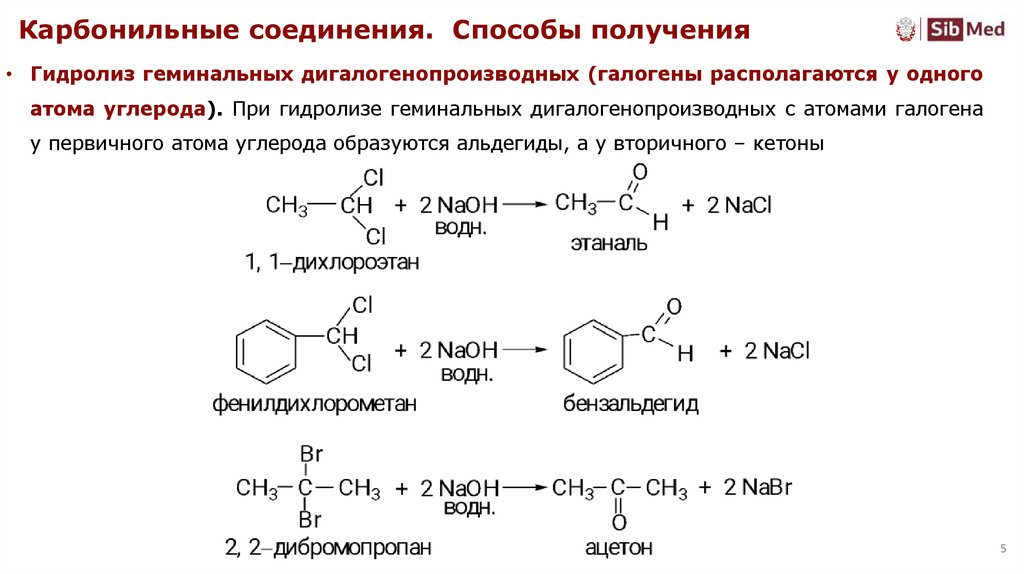
Карбонильные соединения. Способы получения• Гидролиз геминальных дигалогенопроизводных (галогены располагаются у одного
атома углерода). При гидролизе геминальных дигалогенопроизводных с атомами галогена
у первичного атома углерода образуются альдегиды, а у вторичного – кетоны
5
6.
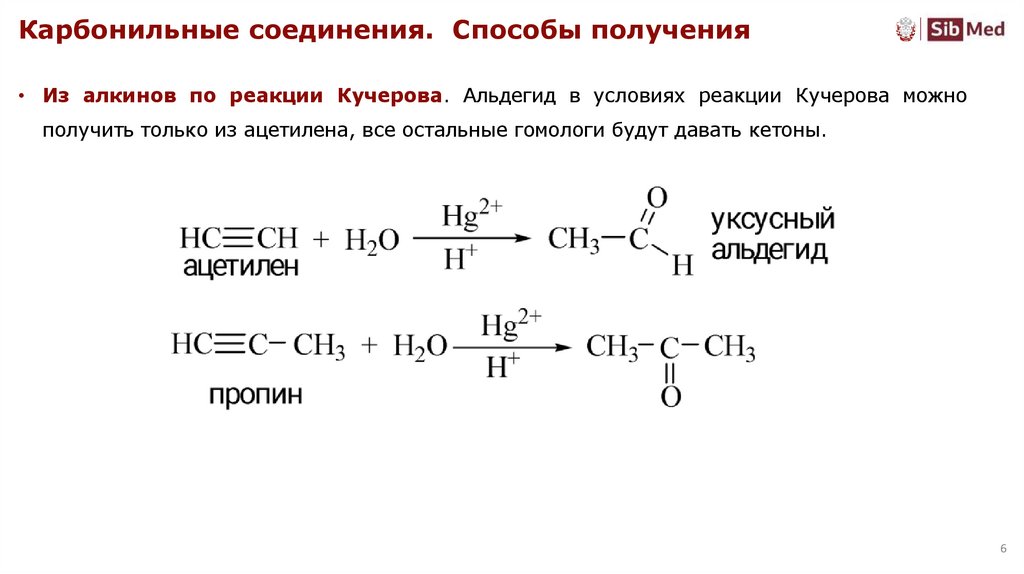
Карбонильные соединения. Способы получения• Из алкинов по реакции Кучерова. Альдегид в условиях реакции Кучерова можно
получить только из ацетилена, все остальные гомологи будут давать кетоны.
6
7.
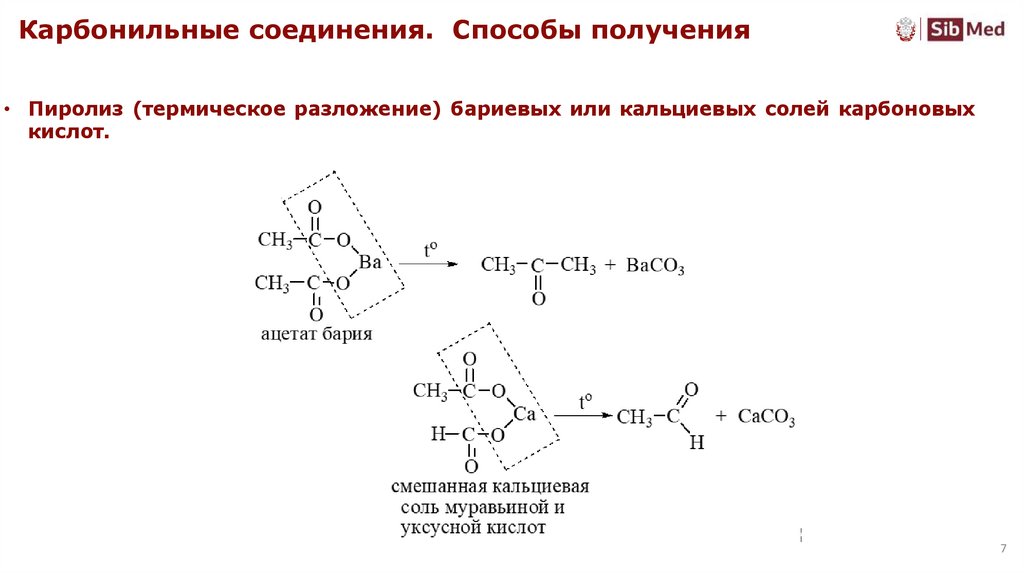
Карбонильные соединения. Способы получения• Пиролиз (термическое разложение) бариевых или кальциевых солей карбоновых
кислот.
7
8.
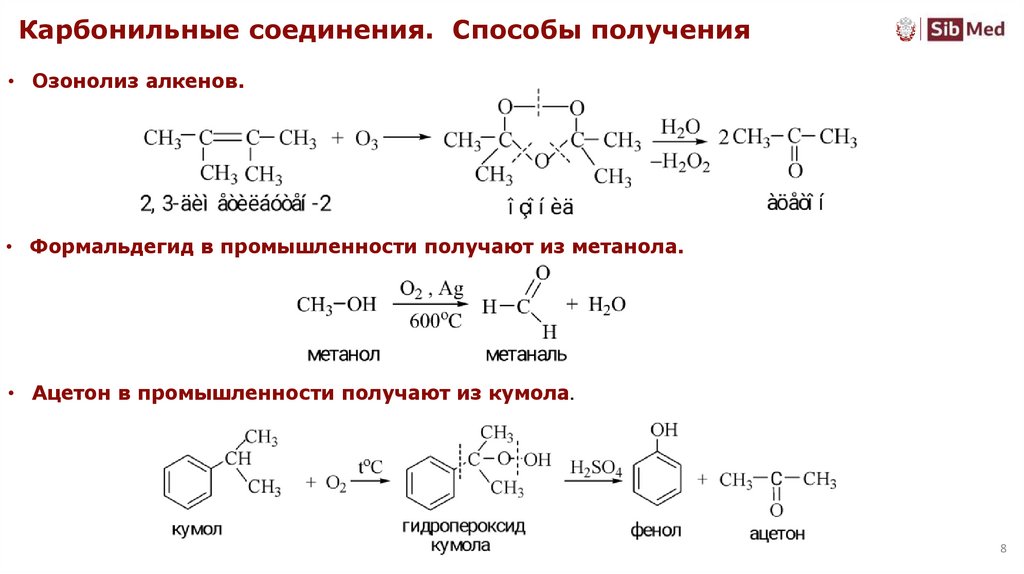
Карбонильные соединения. Способы получения• Озонолиз алкенов.
• Формальдегид в промышленности получают из метанола.
• Ацетон в промышленности получают из кумола.
8
9.
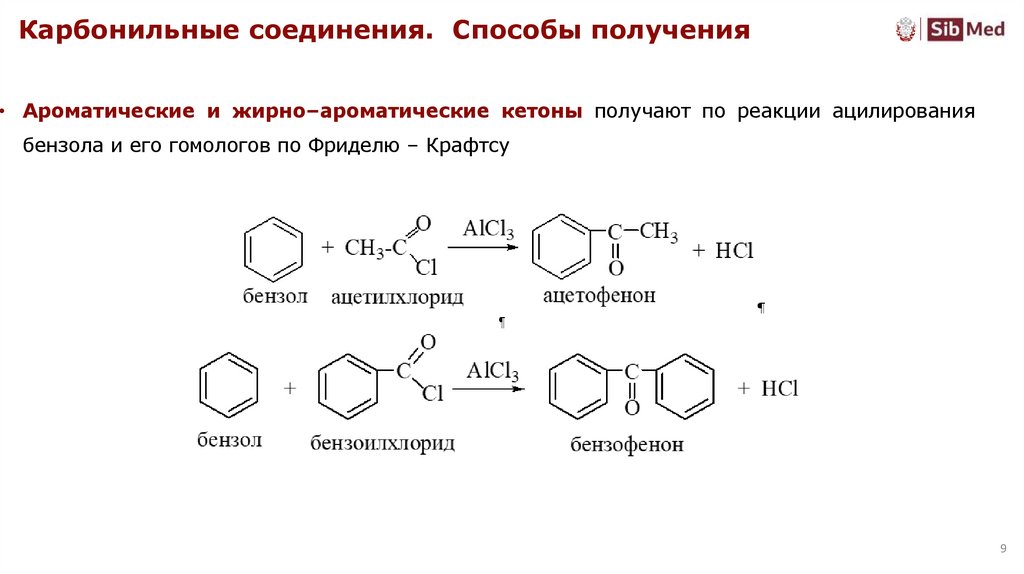
Карбонильные соединения. Способы получения• Ароматические и жирно–ароматические кетоны получают по реакции ацилирования
бензола и его гомологов по Фриделю – Крафтсу
9
10.
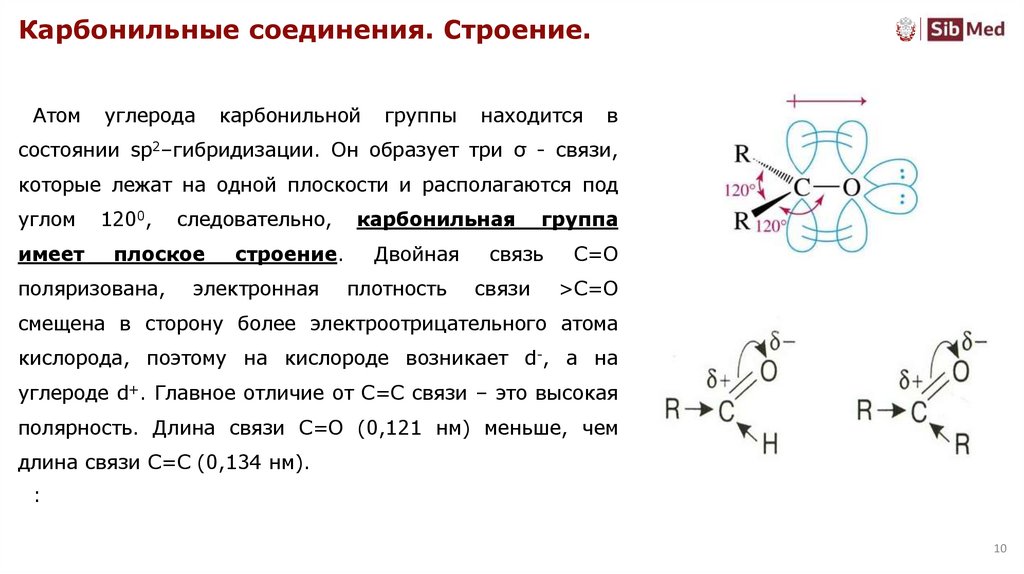
Карбонильные соединения. Строение.Атом
углерода
карбонильной
группы
находится
в
состоянии sp2–гибридизации. Он образует три σ - связи,
которые лежат на одной плоскости и располагаются под
углом
имеет
1200,
следовательно,
плоское
поляризована,
строение.
электронная
карбонильная
группа
Двойная
связь
С=О
плотность
связи
>C=O
смещена в сторону более электроотрицательного атома
кислорода, поэтому на кислороде возникает d-, а на
углероде d+. Главное отличие от С=С связи – это высокая
полярность. Длина связи С=О (0,121 нм) меньше, чем
длина связи С=С (0,134 нм).
:
10
11.
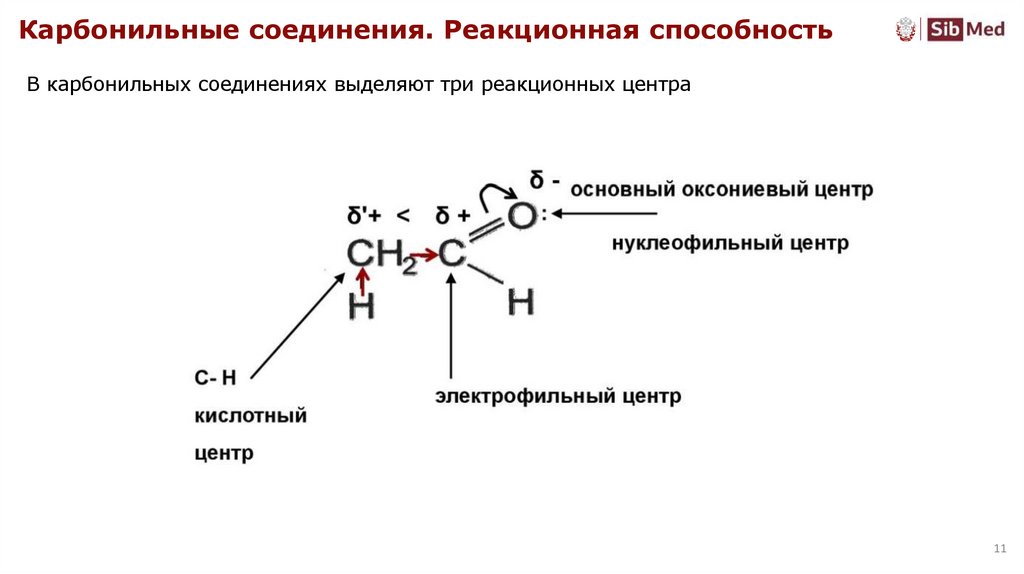
Карбонильные соединения. Реакционная способностьВ карбонильных соединениях выделяют три реакционных центра
11
12.
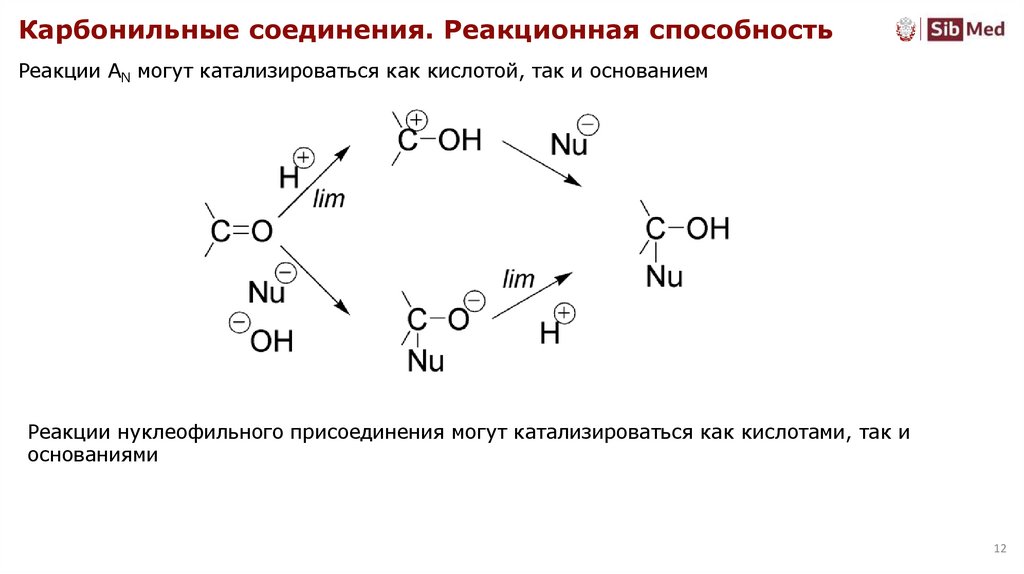
Карбонильные соединения. Реакционная способностьРеакции AN могут катализироваться как кислотой, так и основанием
Реакции нуклеофильного присоединения могут катализироваться как кислотами, так и
основаниями
12
13.
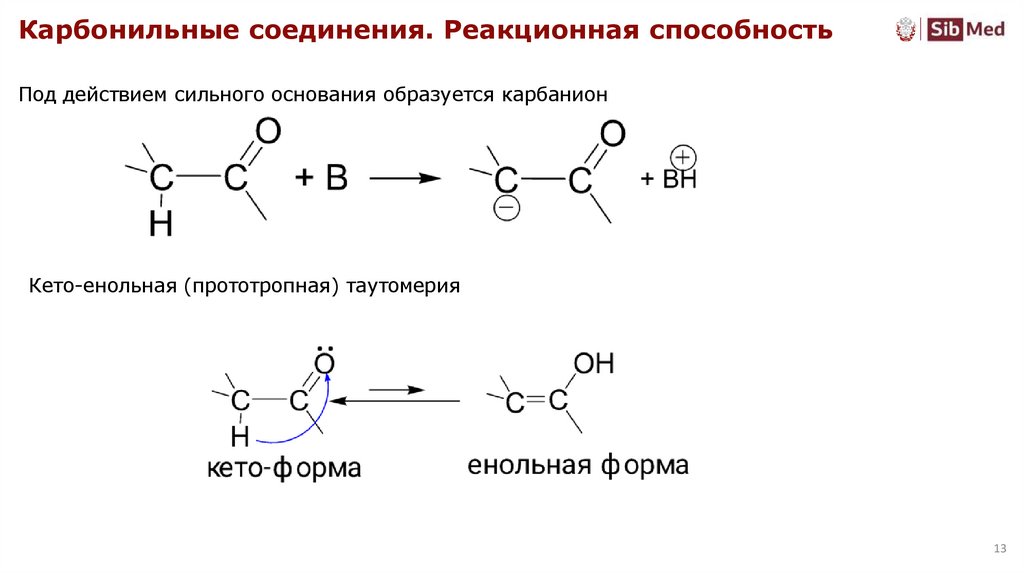
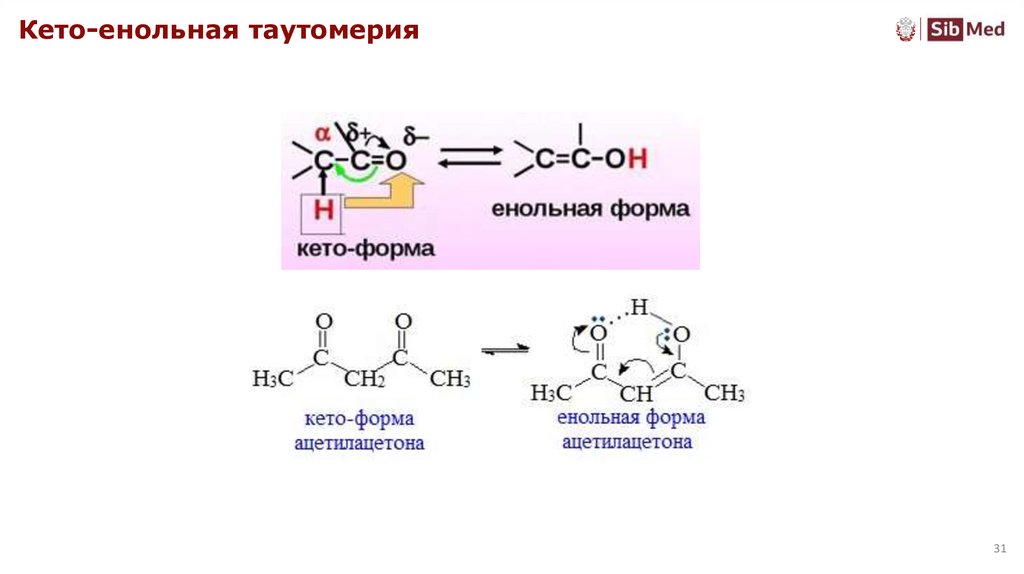
Карбонильные соединения. Реакционная способностьПод действием сильного основания образуется карбанион
Кето-енольная (прототропная) таутомерия
13
14.
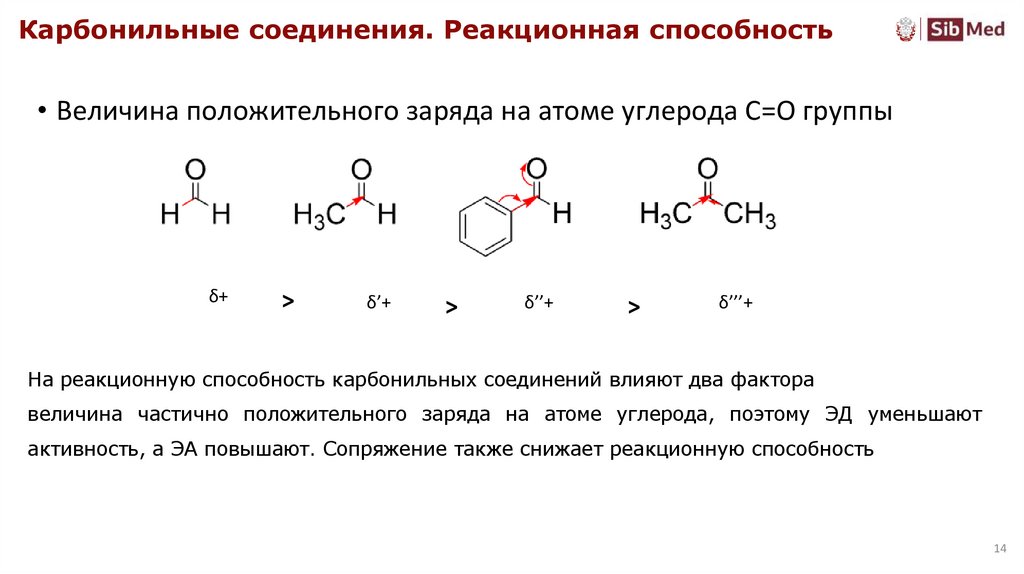
Карбонильные соединения. Реакционная способность• Величина положительного заряда на атоме углерода С=О группы
δ+
>
δ’+
>
δ’’+
>
δ’’’+
На реакционную способность карбонильных соединений влияют два фактора
величина частично положительного заряда на атоме углерода, поэтому ЭД уменьшают
активность, а ЭА повышают. Сопряжение также снижает реакционную способность
14
15.
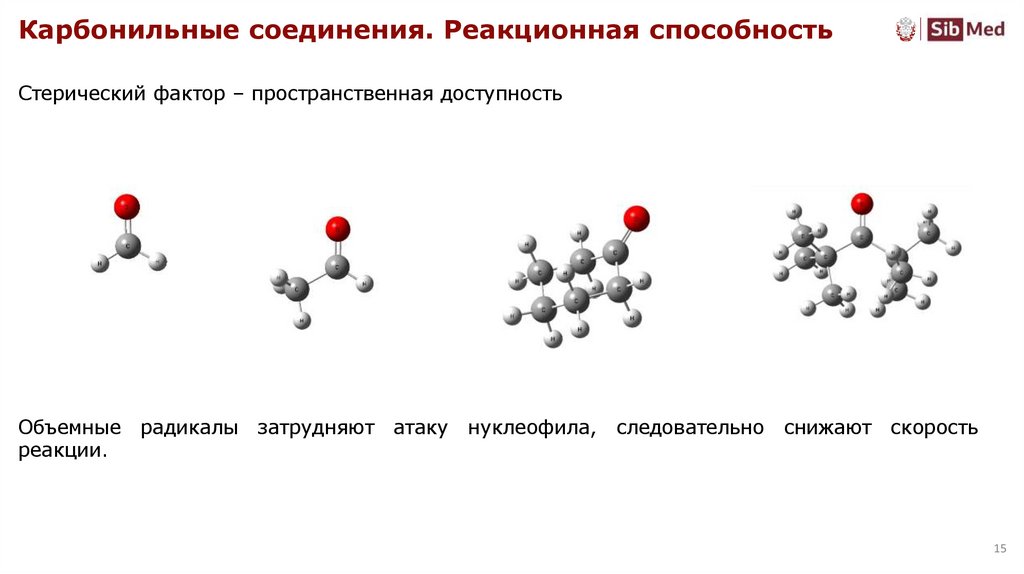
Карбонильные соединения. Реакционная способностьСтерический фактор – пространственная доступность
Объемные радикалы затрудняют
реакции.
атаку
нуклеофила,
следовательно снижают скорость
15
16.
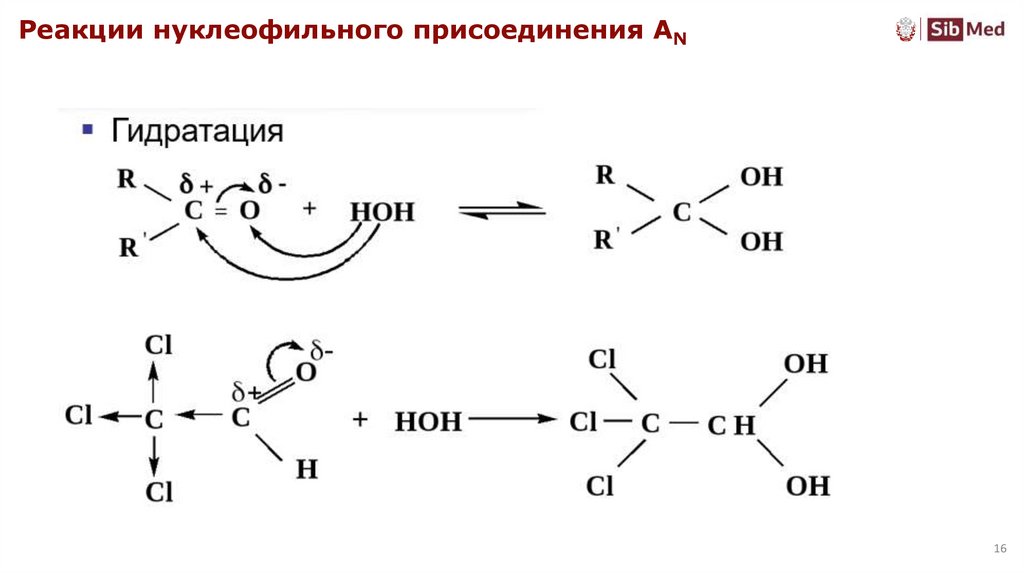
Реакции нуклеофильного присоединения AN16
17.
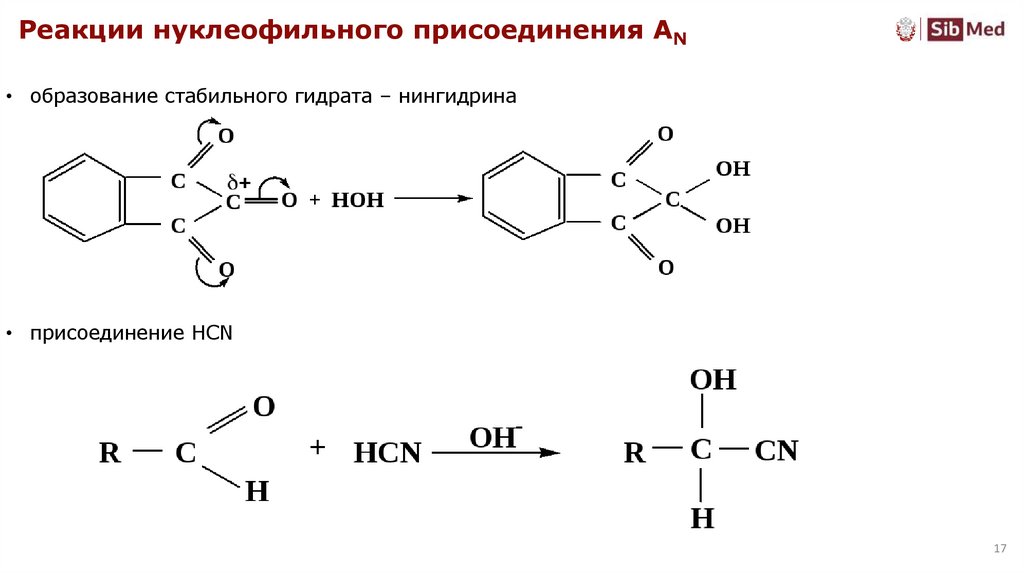
Реакции нуклеофильного присоединения AN• образование стабильного гидрата – нингидрина
• присоединение HCN
17
18.
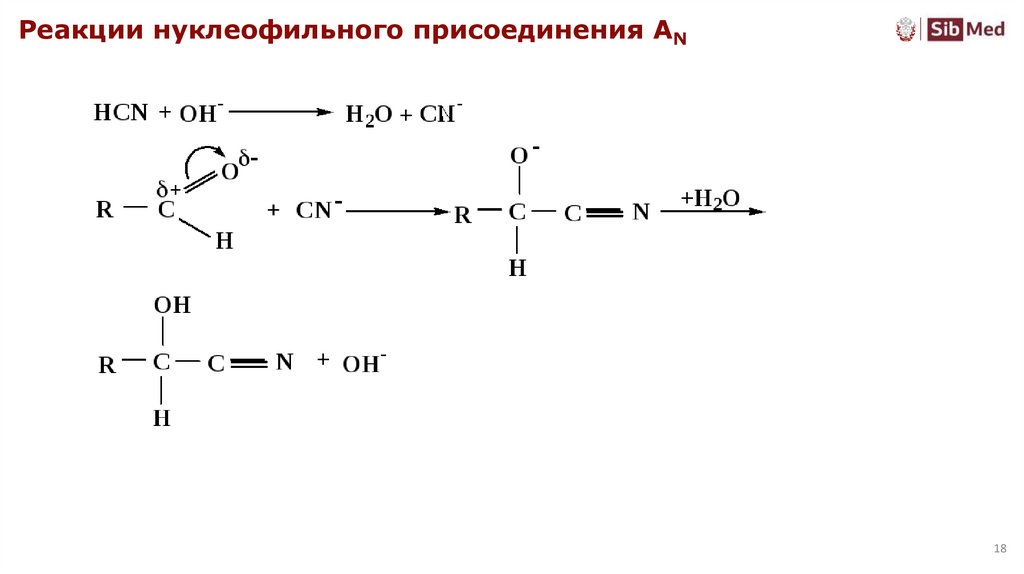
Реакции нуклеофильного присоединения AN18
19.
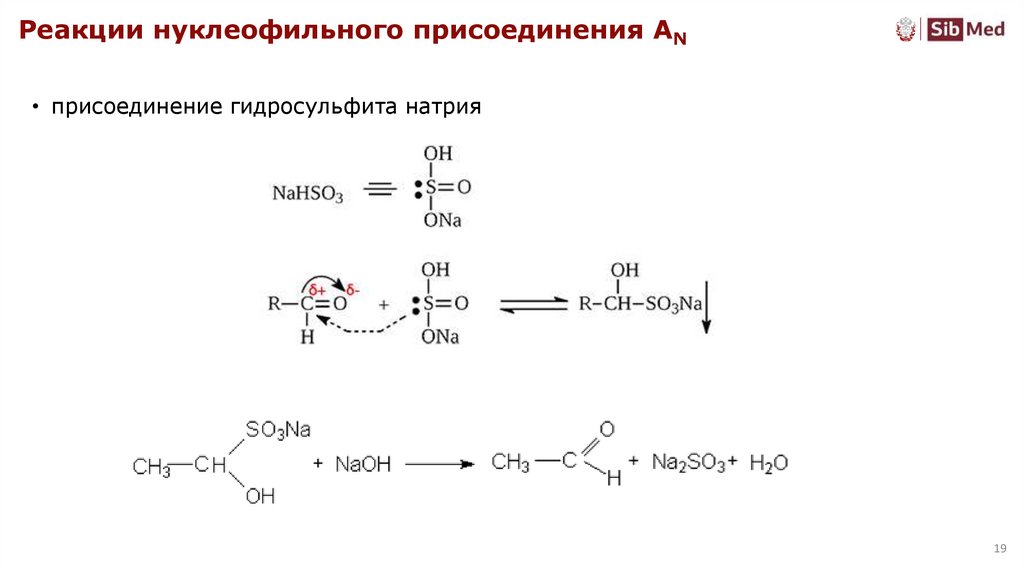
Реакции нуклеофильного присоединения AN• присоединение гидросульфита натрия
19
20.
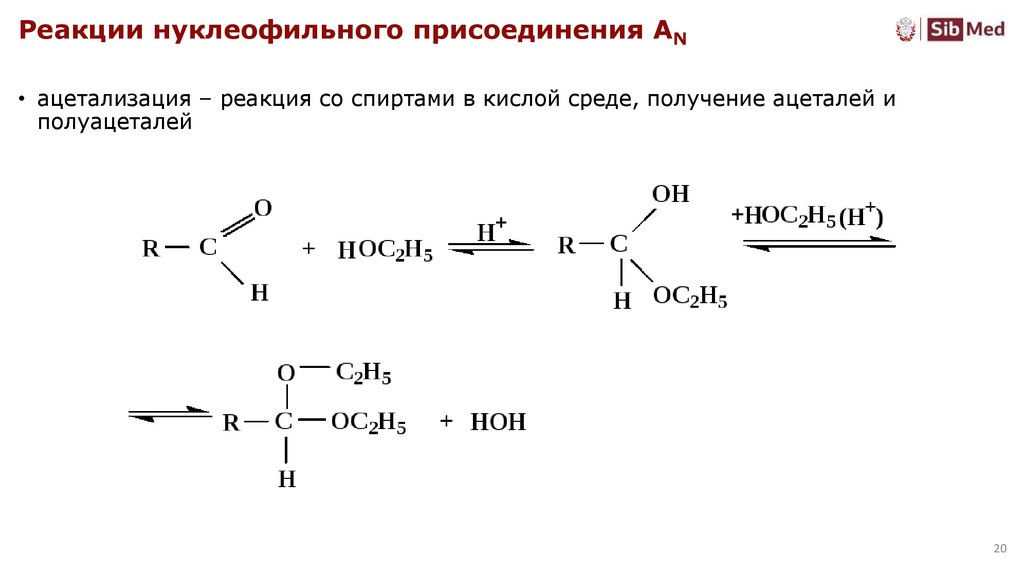
Реакции нуклеофильного присоединения AN• ацетализация – реакция со спиртами в кислой среде, получение ацеталей и
полуацеталей
20
21.
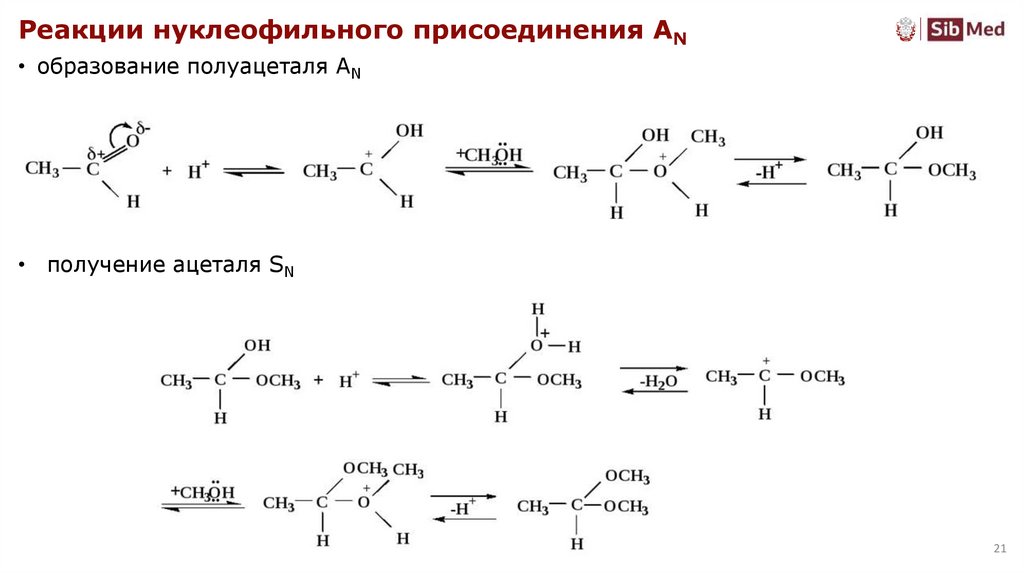
Реакции нуклеофильного присоединения AN• образование полуацеталя AN
• получение ацеталя SN
21
22.
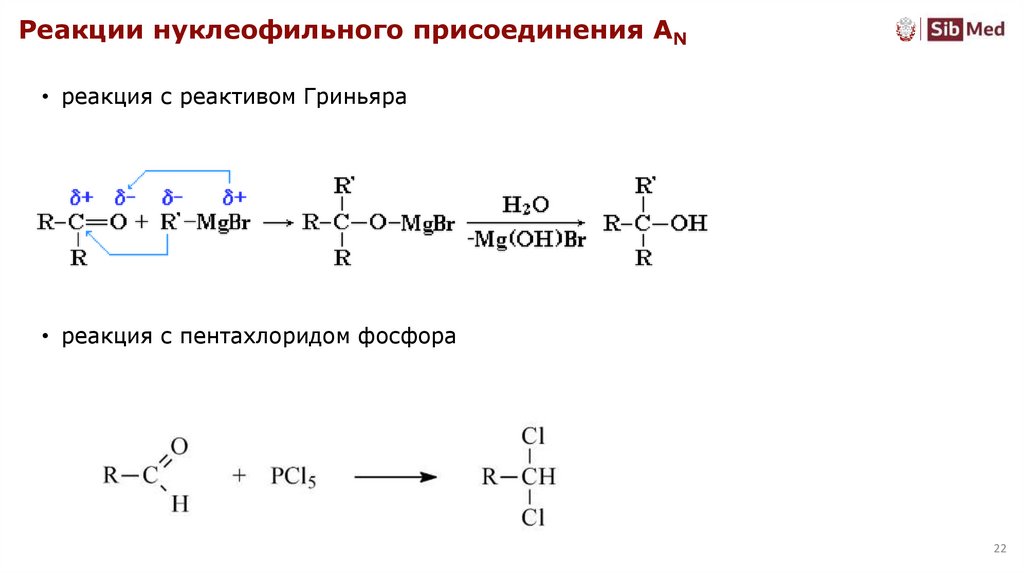
Реакции нуклеофильного присоединения AN• реакция с реактивом Гриньяра
• реакция с пентахлоридом фосфора
22
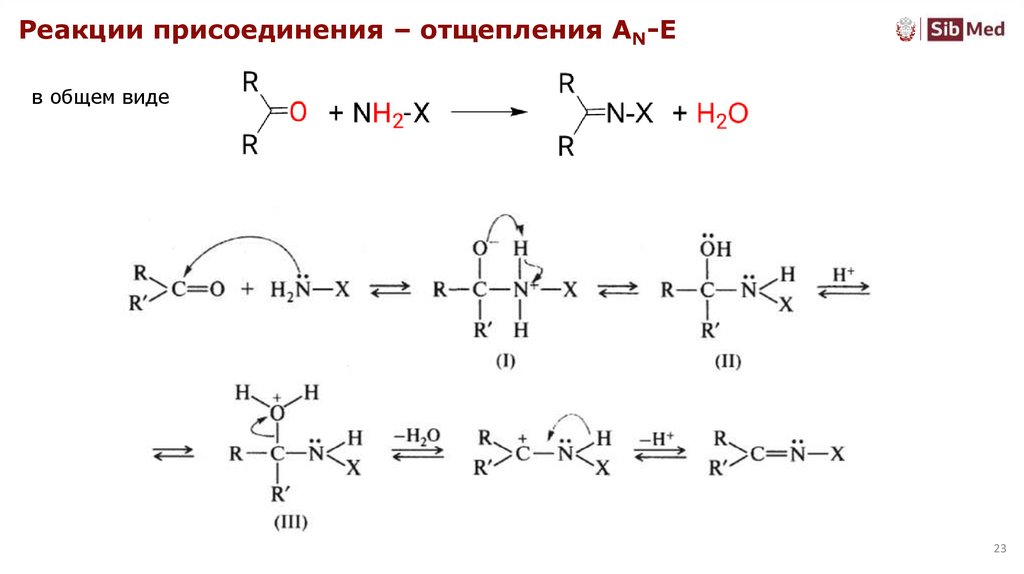
23.
Реакции присоединения – отщепления AN-Eв общем виде
23
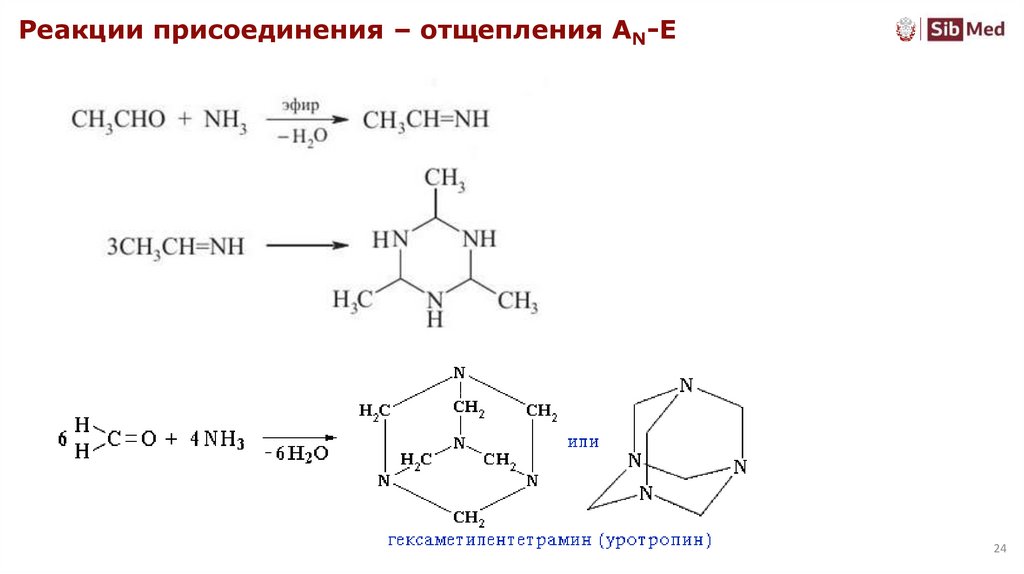
24.
Реакции присоединения – отщепления AN-E24
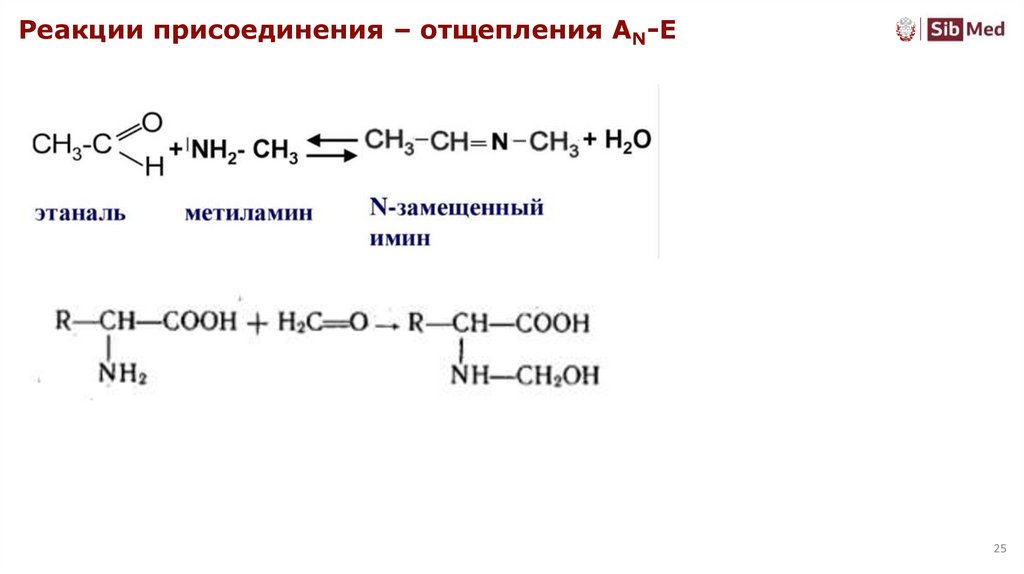
25.
Реакции присоединения – отщепления AN-E25
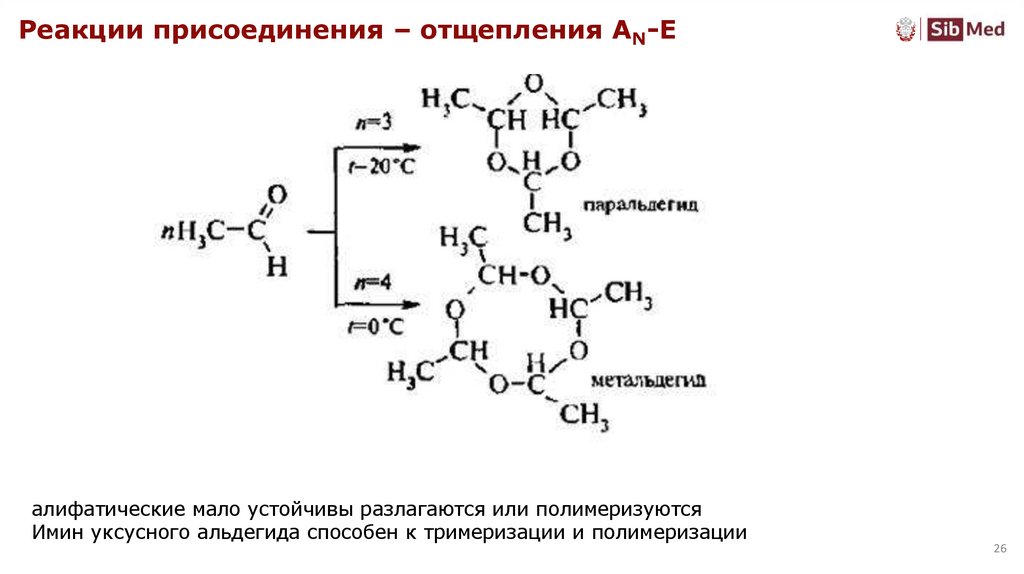
26.
Реакции присоединения – отщепления AN-Eалифатические мало устойчивы разлагаются или полимеризуются
Имин уксусного альдегида способен к тримеризации и полимеризации
26
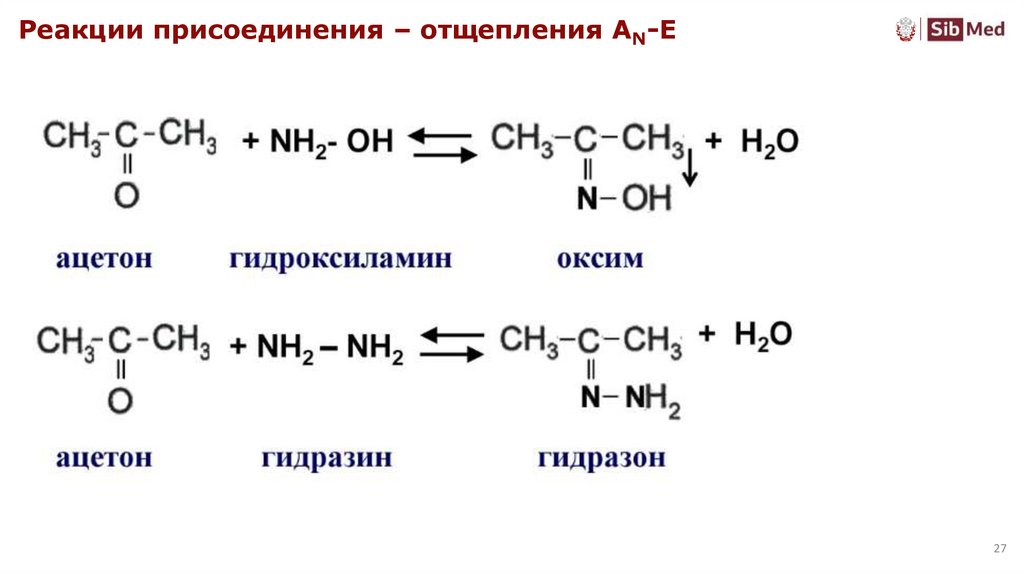
27.
Реакции присоединения – отщепления AN-E27
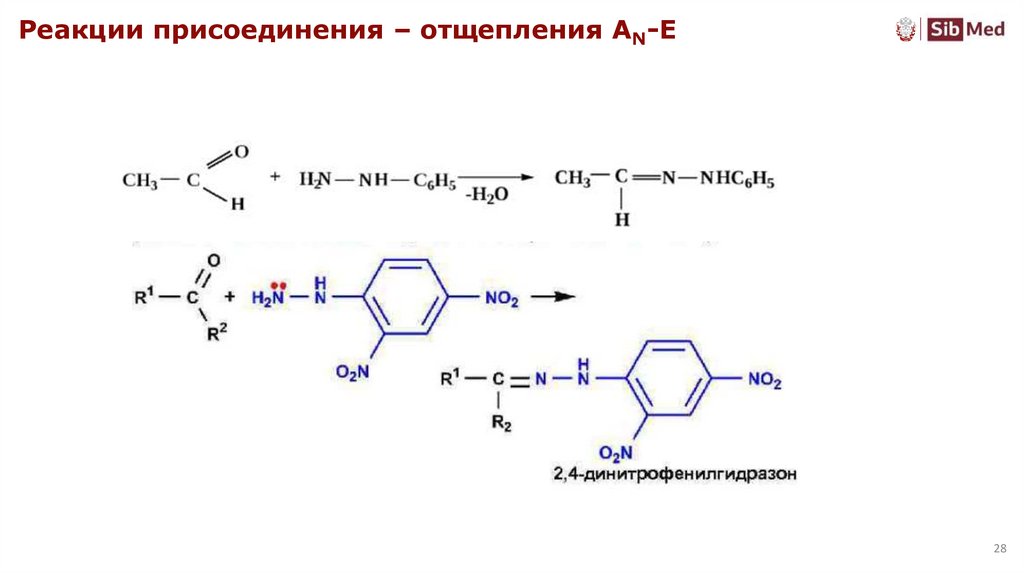
28.
Реакции присоединения – отщепления AN-E28
29.
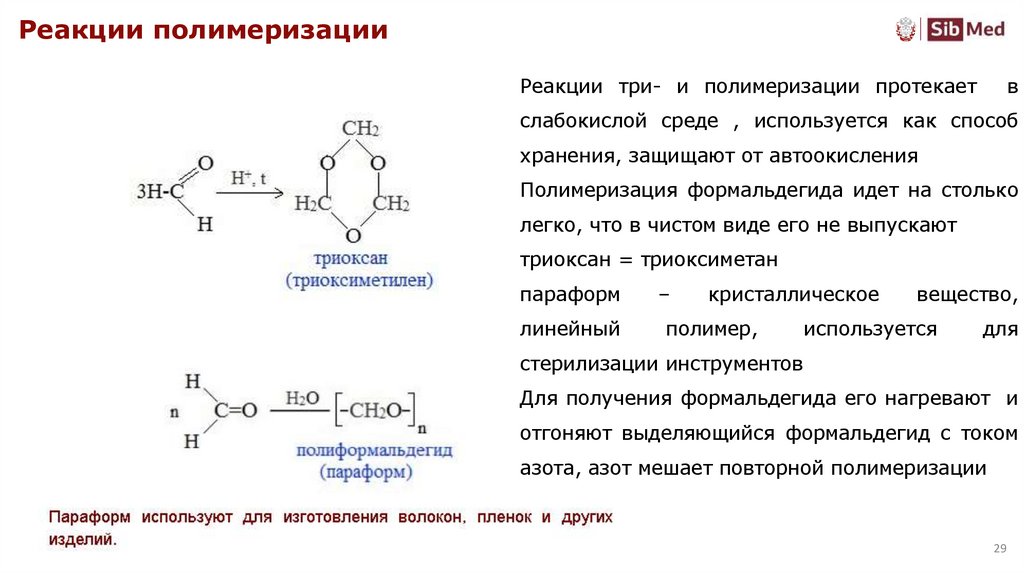
Реакции полимеризацииРеакции три- и полимеризации протекает
в
слабокислой среде , используется как способ
хранения, защищают от автоокисления
Полимеризация формальдегида идет на столько
легко, что в чистом виде его не выпускают
триоксан = триоксиметан
параформ
–
кристаллическое
линейный
полимер,
вещество,
используется
для
стерилизации инструментов
Для получения формальдегида его нагревают и
отгоняют выделяющийся формальдегид с током
азота, азот мешает повторной полимеризации
29
30.
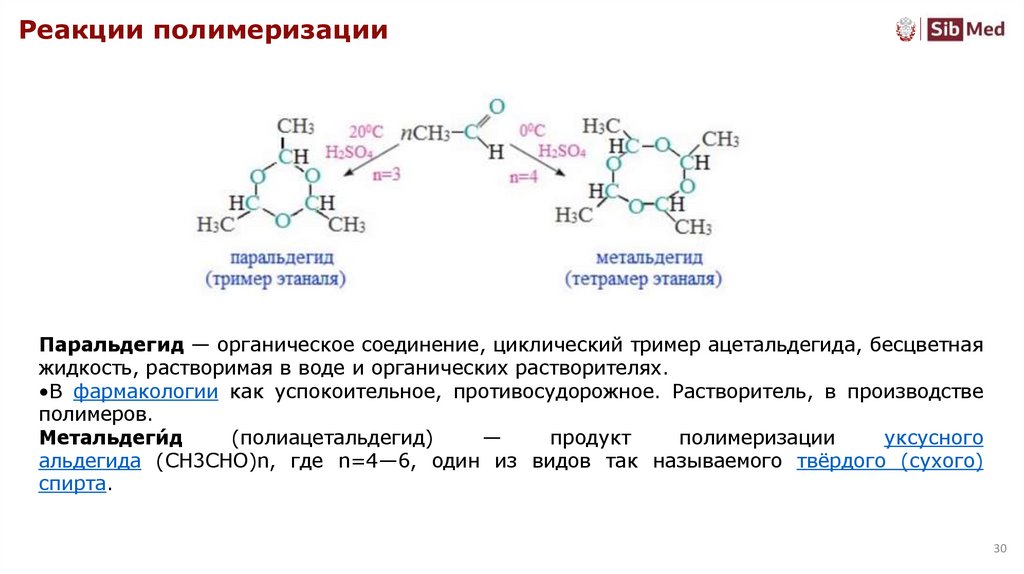
Реакции полимеризацииПаральдегид — органическое соединение, циклический тример ацетальдегида, бесцветная
жидкость, растворимая в воде и органических растворителях.
•В фармакологии как успокоительное, противосудорожное. Растворитель, в производстве
полимеров.
Метальдеги́д
(полиацетальдегид)
—
продукт
полимеризации
уксусного
альдегида (СН3СНО)n, где n=4—6, один из видов так называемого твёрдого (сухого)
спирта.
30
31.
Кето-енольная таутомерия31
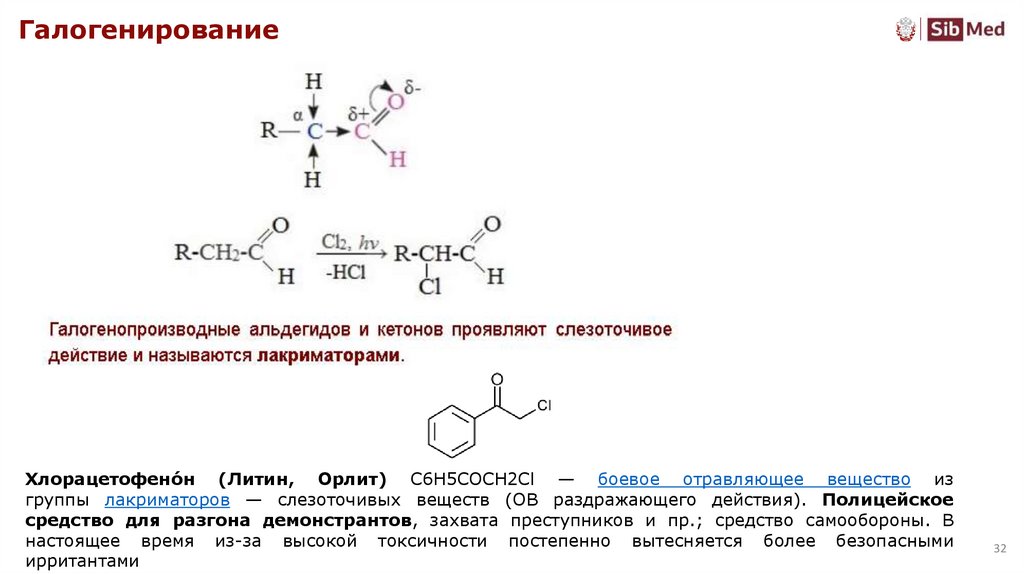
32.
ГалогенированиеХлорацетофено́н (Литин, Орлит) C6H5COCH2Cl — боевое отравляющее вещество из
группы лакриматоров — слезоточивых веществ (ОВ раздражающего действия). Полицейское
средство для разгона демонстрантов, захвата преступников и пр.; средство самообороны. В
настоящее время из-за высокой токсичности постепенно вытесняется более безопасными
ирритантами
32
33.
Галоформная проба33
34.
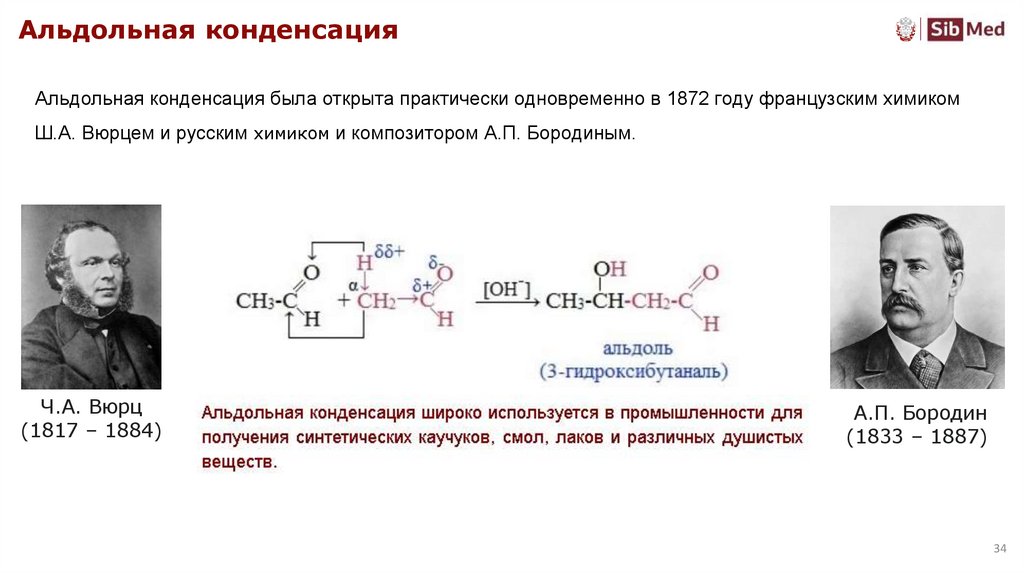
Альдольная конденсацияАльдольная конденсация была открыта практически одновременно в 1872 году французским химиком
Ш.А. Вюрцем и русским химиком и композитором А.П. Бородиным.
Ч.А. Вюрц
(1817 – 1884)
А.П. Бородин
(1833 – 1887)
34
35.
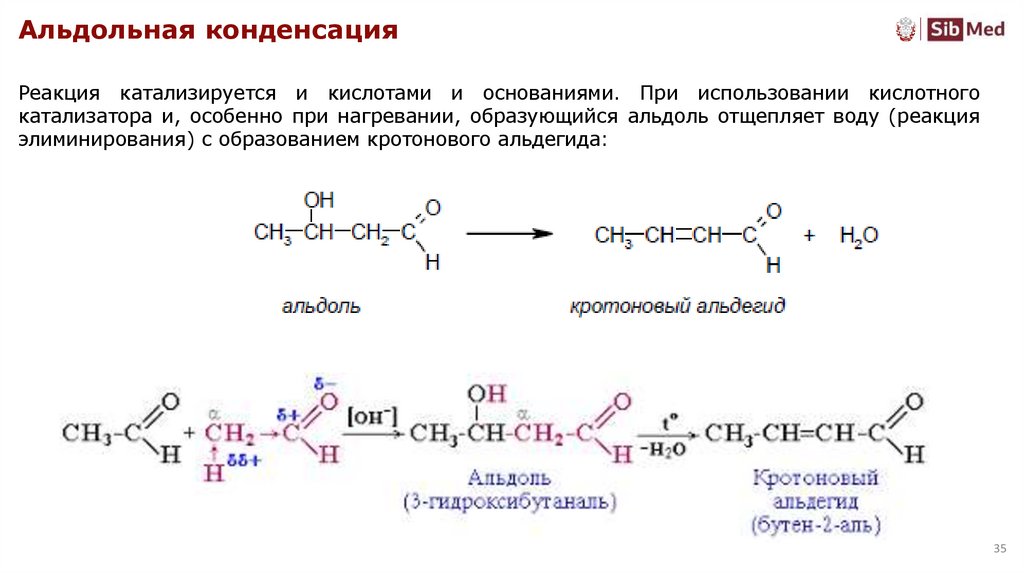
Альдольная конденсацияРеакция катализируется и кислотами и основаниями. При использовании кислотного
катализатора и, особенно при нагревании, образующийся альдоль отщепляет воду (реакция
элиминирования) с образованием кротонового альдегида:
35
36.
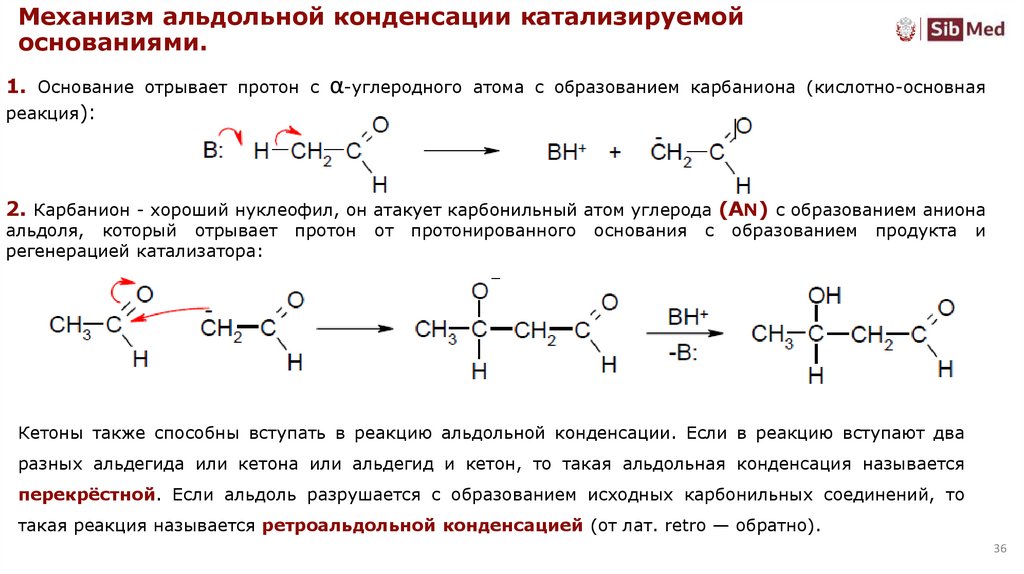
Механизм альдольной конденсации катализируемойоснованиями.
1. Основание отрывает протон с α-углеродного атома с образованием карбаниона (кислотно-основная
реакция):
2. Карбанион - хороший нуклеофил, он атакует карбонильный атом углерода (AN) с образованием аниона
альдоля, который отрывает
регенерацией катализатора:
протон
от
протонированного
основания
с
образованием
продукта
и
Кетоны также способны вступать в реакцию альдольной конденсации. Если в реакцию вступают два
разных альдегида или кетона или альдегид и кетон, то такая альдольная конденсация называется
перекрёстной. Если альдоль разрушается с образованием исходных карбонильных соединений, то
такая реакция называется ретроальдольной конденсацией (от лат. retro — обратно).
36
37.
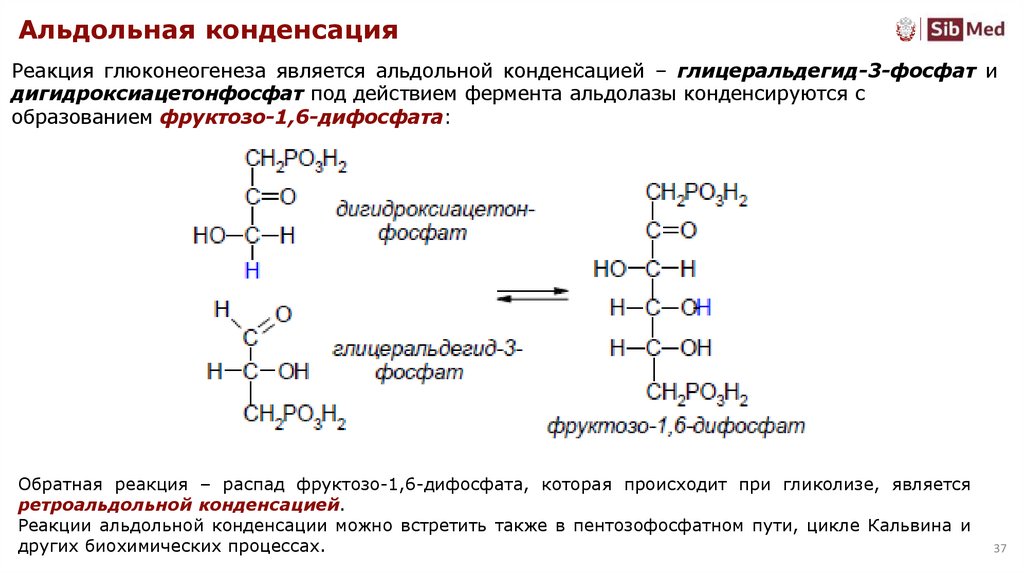
Альдольная конденсацияРеакция глюконеогенеза является альдольной конденсацией – глицеральдегид-3-фосфат и
дигидроксиацетонфосфат под действием фермента альдолазы конденсируются с
образованием фруктозо-1,6-дифосфата:
Обратная реакция – распад фруктозо-1,6-дифосфата, которая происходит при гликолизе, является
ретроальдольной конденсацией.
Реакции альдольной конденсации можно встретить также в пентозофосфатном пути, цикле Кальвина и
других биохимических процессах.
37
38.
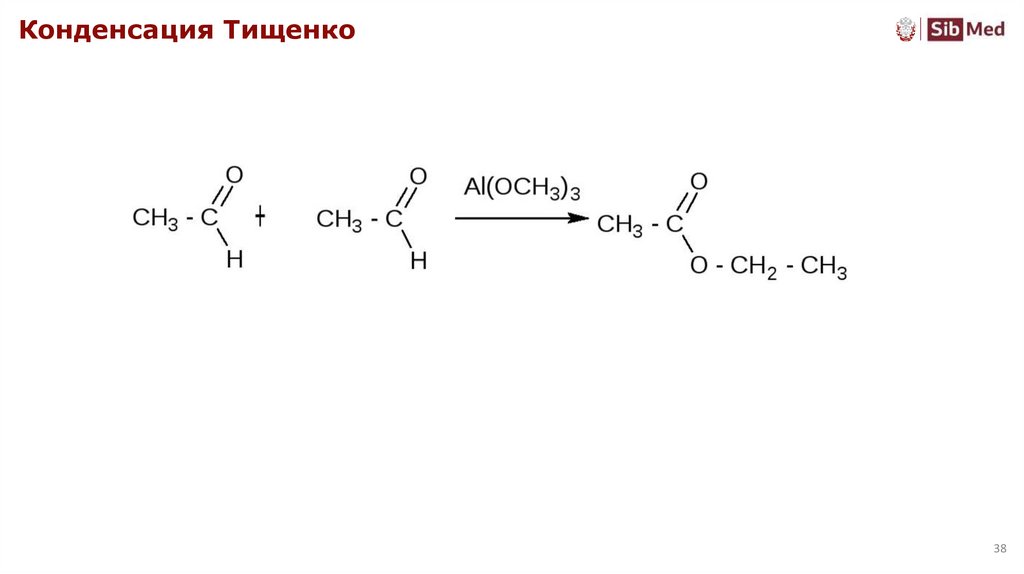
Конденсация Тищенко38
39.
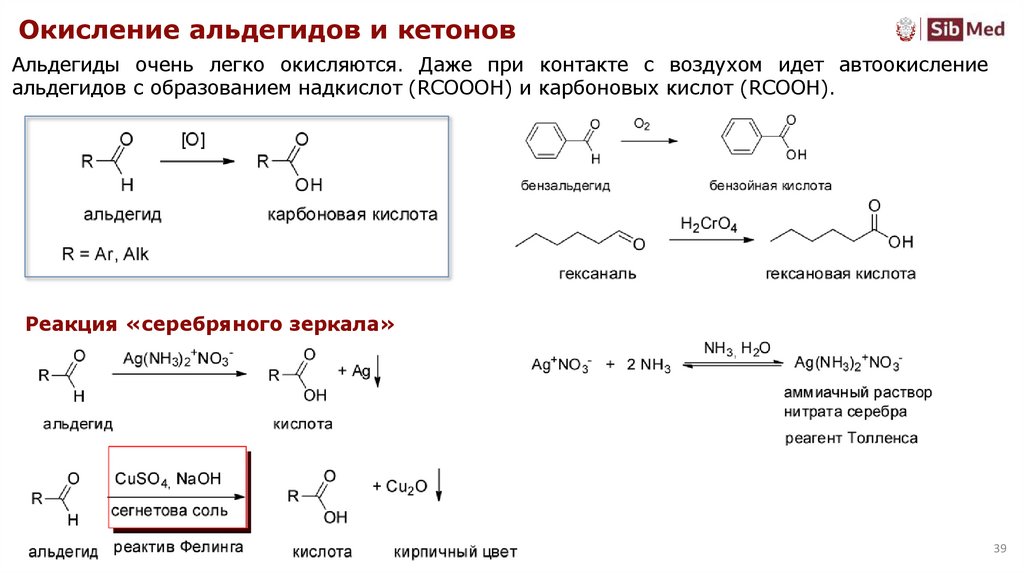
Окисление альдегидов и кетоновАльдегиды очень легко окисляются. Даже при контакте с воздухом идет автоокисление
альдегидов с образованием надкислот (RCOOOH) и карбоновых кислот (RCOOH).
Реакция «серебряного зеркала»
39
40.
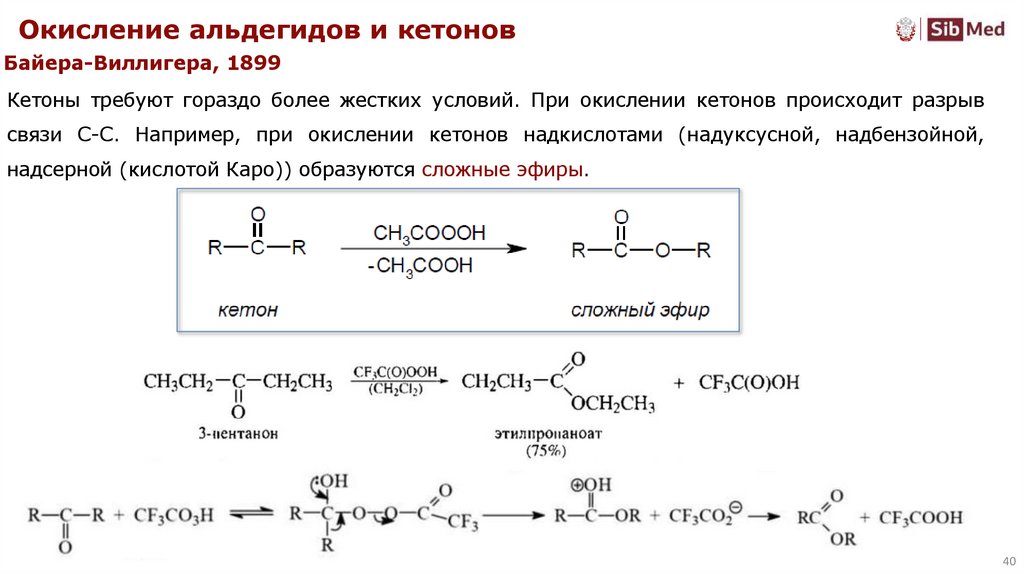
Окисление альдегидов и кетоновБайера-Виллигера, 1899
Кетоны требуют гораздо более жестких условий. При окислении кетонов происходит разрыв
связи C-C. Например, при окислении кетонов надкислотами (надуксусной, надбензойной,
надсерной (кислотой Каро)) образуются сложные эфиры.
40
41.
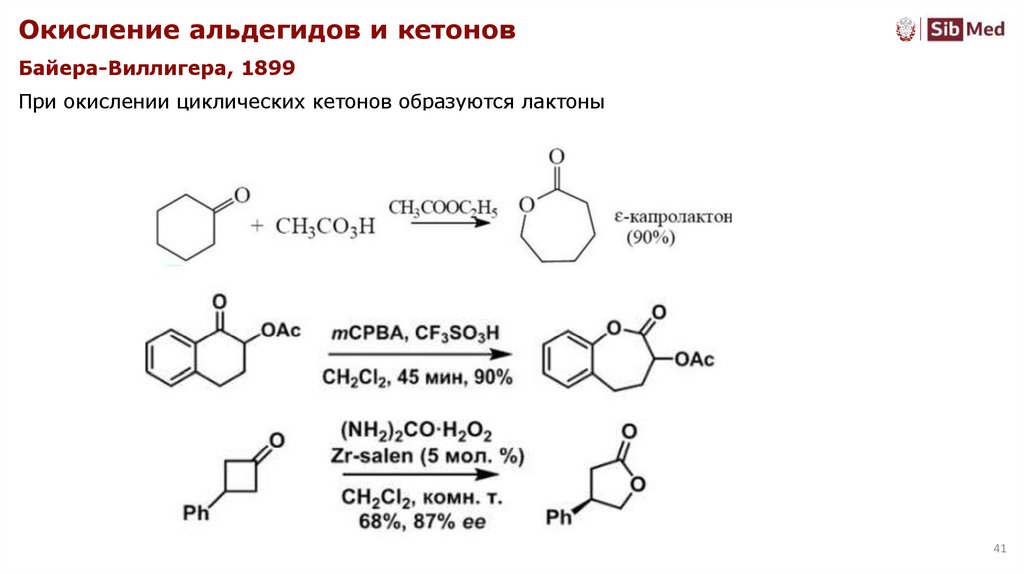
Окисление альдегидов и кетоновБайера-Виллигера, 1899
При окислении циклических кетонов образуются лактоны
41
42.
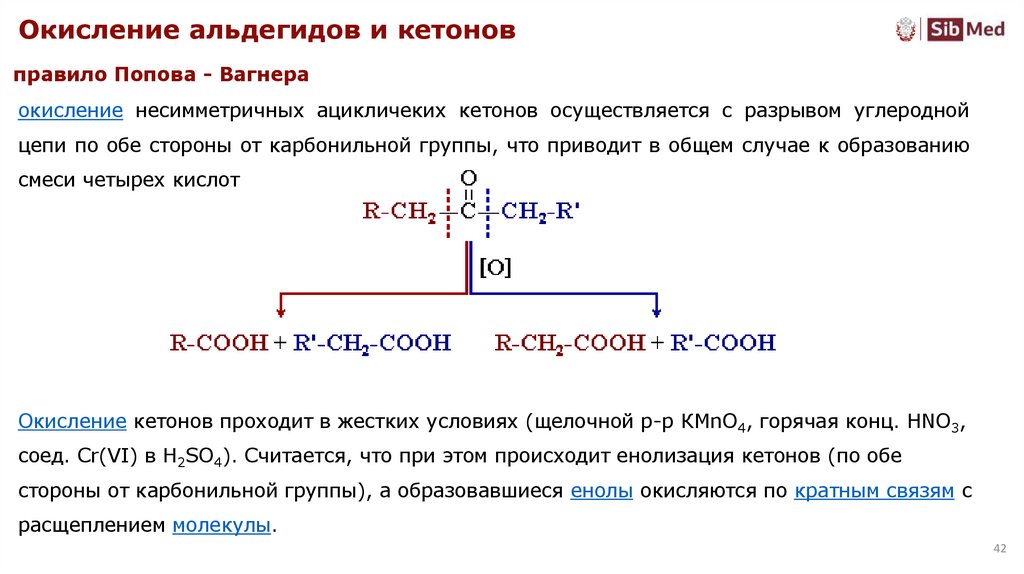
Окисление альдегидов и кетоновправило Попова - Вагнера
окисление несимметричных ацикличеких кетонов осуществляется с разрывом углеродной
цепи по обе стороны от карбонильной группы, что приводит в общем случае к образованию
смеси четырех кислот
Окисление кетонов проходит в жестких условиях (щелочной р-р КМnО4, горячая конц. HNO3,
соед. Cr(VI) в Н2SO4). Считается, что при этом происходит енолизация кетонов (по обе
стороны от карбонильной группы), а образовавшиеся енолы окисляются по кратным связям с
расщеплением молекулы.
42
43.
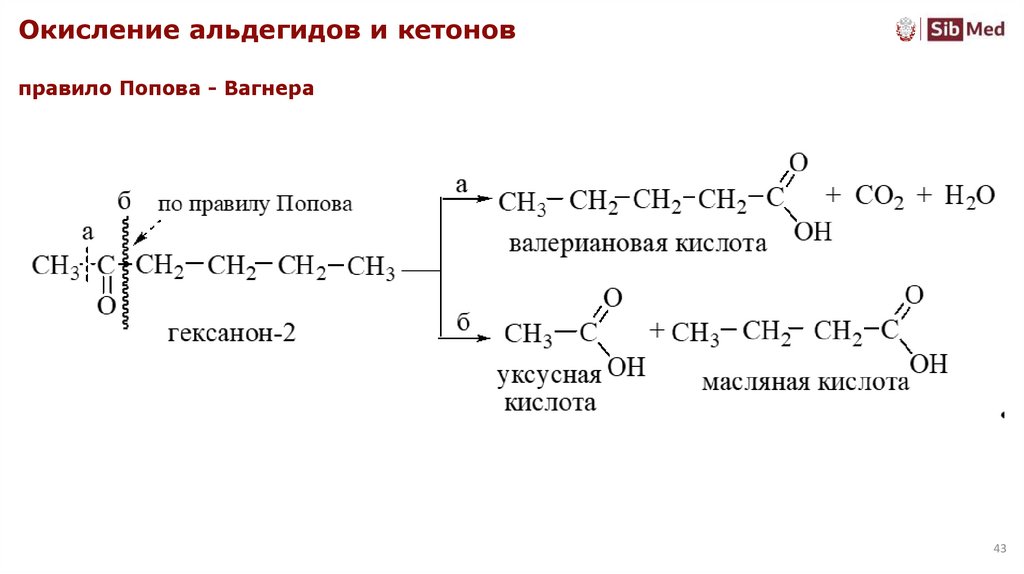
Окисление альдегидов и кетоновправило Попова - Вагнера
43
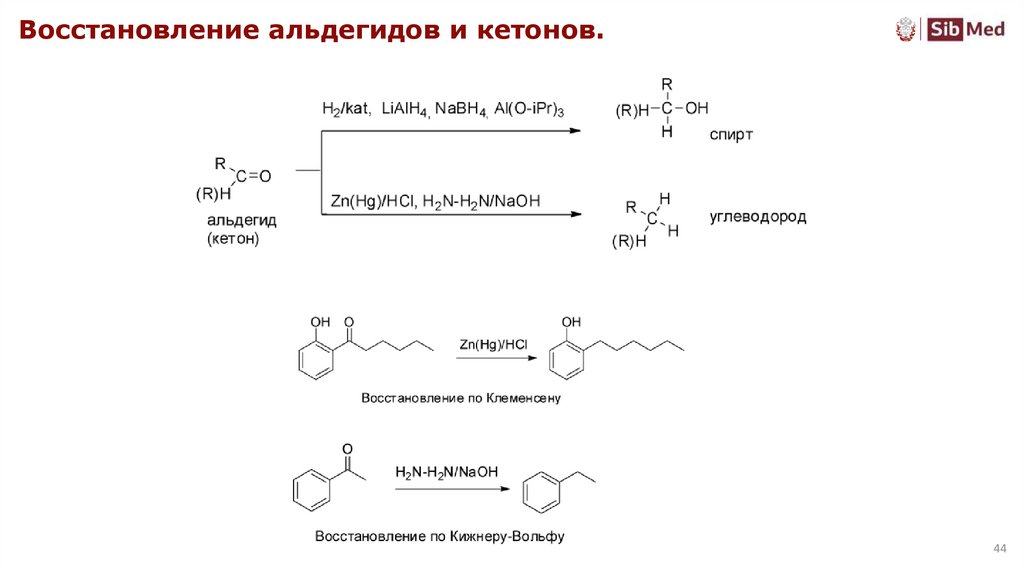
44.
Восстановление альдегидов и кетонов.44
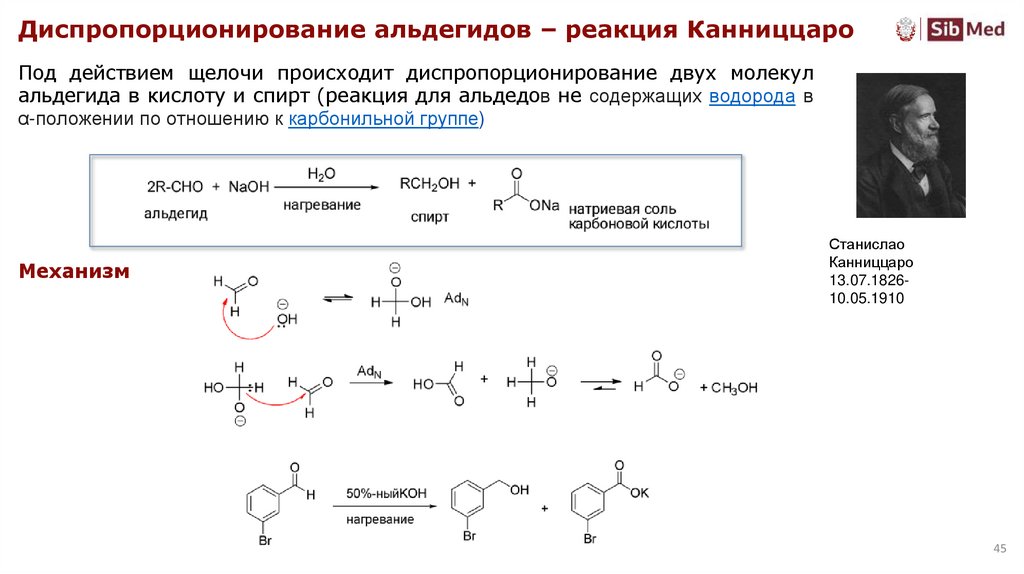
45.
Диспропорционирование альдегидов – реакция КанниццароПод действием щелочи происходит диспропорционирование двух молекул
альдегида в кислоту и спирт (реакция для альдедов не содержащих водорода в
α-положении по отношению к карбонильной группе)
Механизм
Станислао
Канниццаро
13.07.182610.05.1910
45
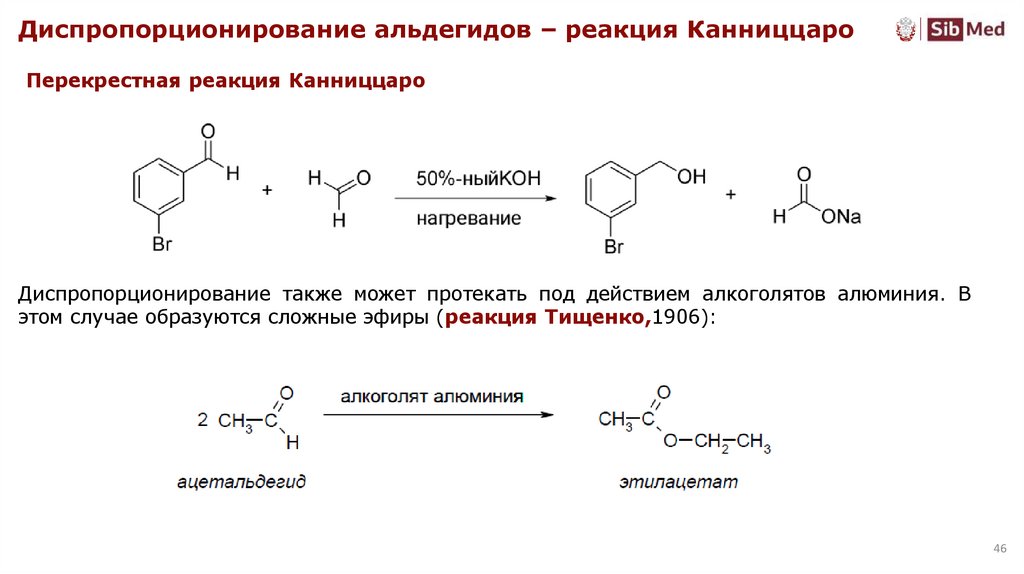
46.
Диспропорционирование альдегидов – реакция КанниццароПерекрестная реакция Канниццаро
Диспропорционирование также может протекать под действием алкоголятов алюминия. В
этом случае образуются сложные эфиры (реакция Тищенко,1906):
46



 Химия
Химия








