Похожие презентации:
т.хим связь
1.
24.01.2026. Тема: Химическая связь. Видыхимической связи..
Добрый день, запишите число и тему занятий для
повторения.
Выполнить задание на отдельном листе.
Задание –Вопросы для контроля, сдать на проверку на
следующем очном занятии.
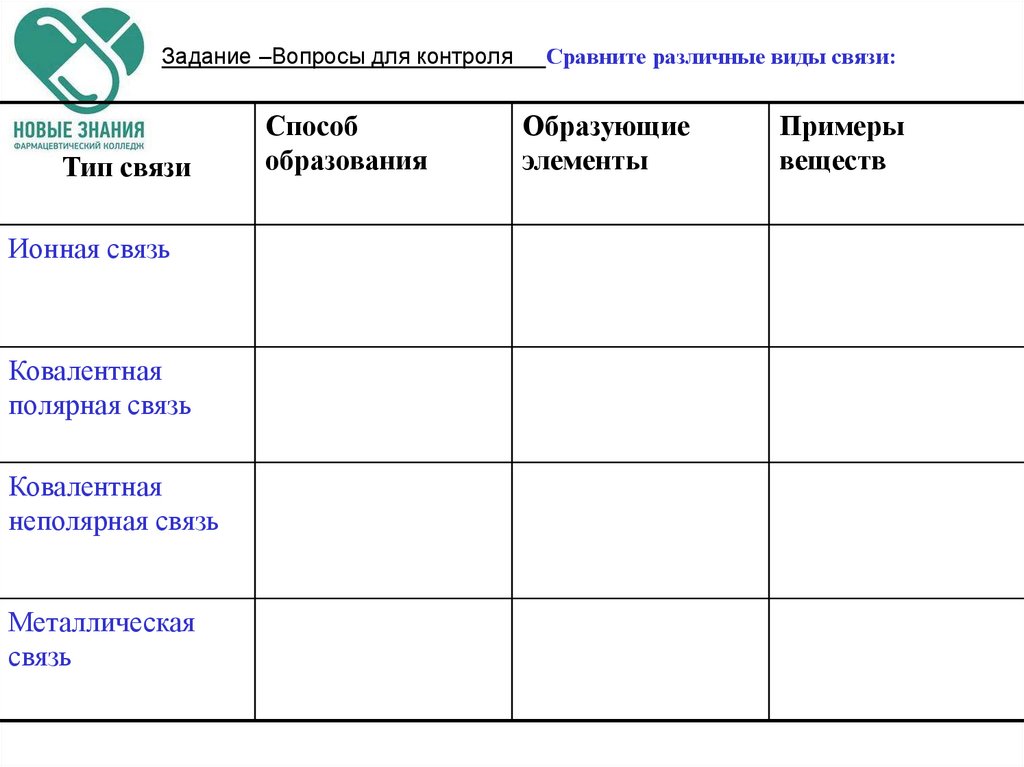
2. Задание –Вопросы для контроля Сравните различные виды связи:
Задание –Вопросы для контроляТип связи
Ионная связь
Ковалентная
полярная связь
Ковалентная
неполярная связь
Металлическая
связь
Способ
образования
Сравните различные виды связи:
Образующие
элементы
Примеры
веществ
3.
ПРИРОДА ХИМИЧЕСКОЙСВЯЗИ
Внешние
электроны
4.
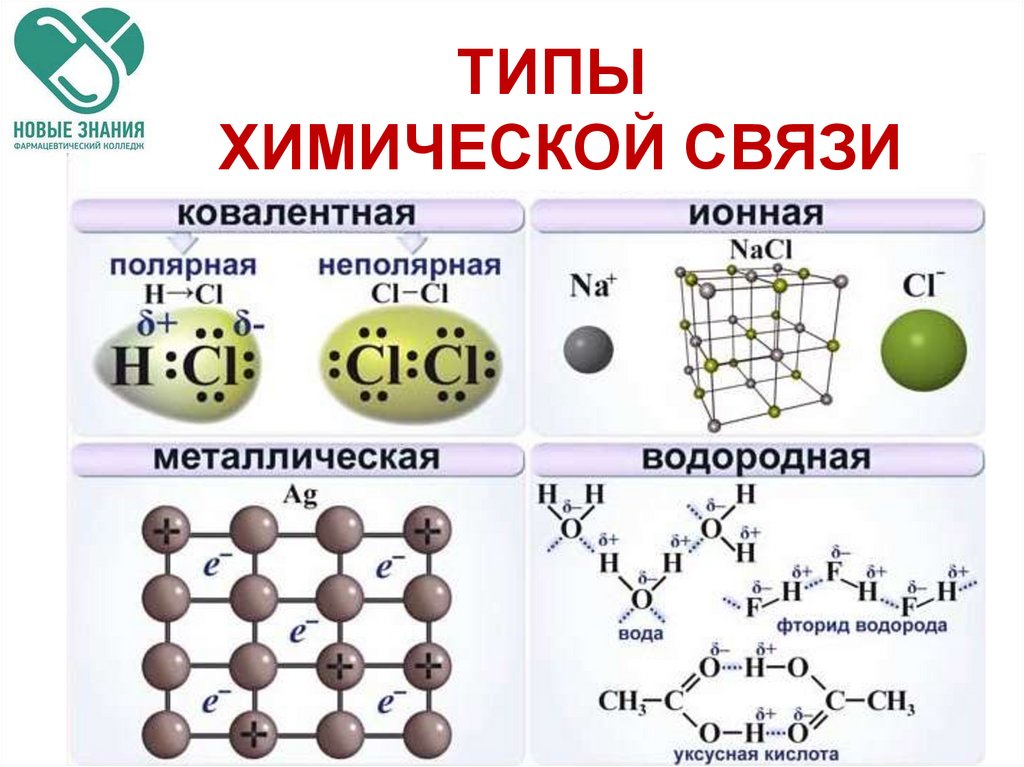
ТИПЫ ХИМИЧЕСКОЙ СВЯЗИОСНОВНЫЕ ТИПЫ:
1.Ковалентная (полярная и
неполярная)
2.Ионная
3.Металлическая.
4.Водородная
химическая
связь.
5.
КОВАЛЕНТНАЯ СВЯЗЬХимическая связь, возникающая в
результате
образования
общих
электронных
пар,
называется
ковалентной.
6. Виды ковалентной связи
Если электронная плотность расположенасимметрично между атомами, ковалентная
связь называется неполярной.
Если электронная плотность смещена в
сторону одного из атомов, то ковалентная
связь называется полярной.
Полярность связи тем больше, чем больше
разность электроотрицательностей
атомов.
7.
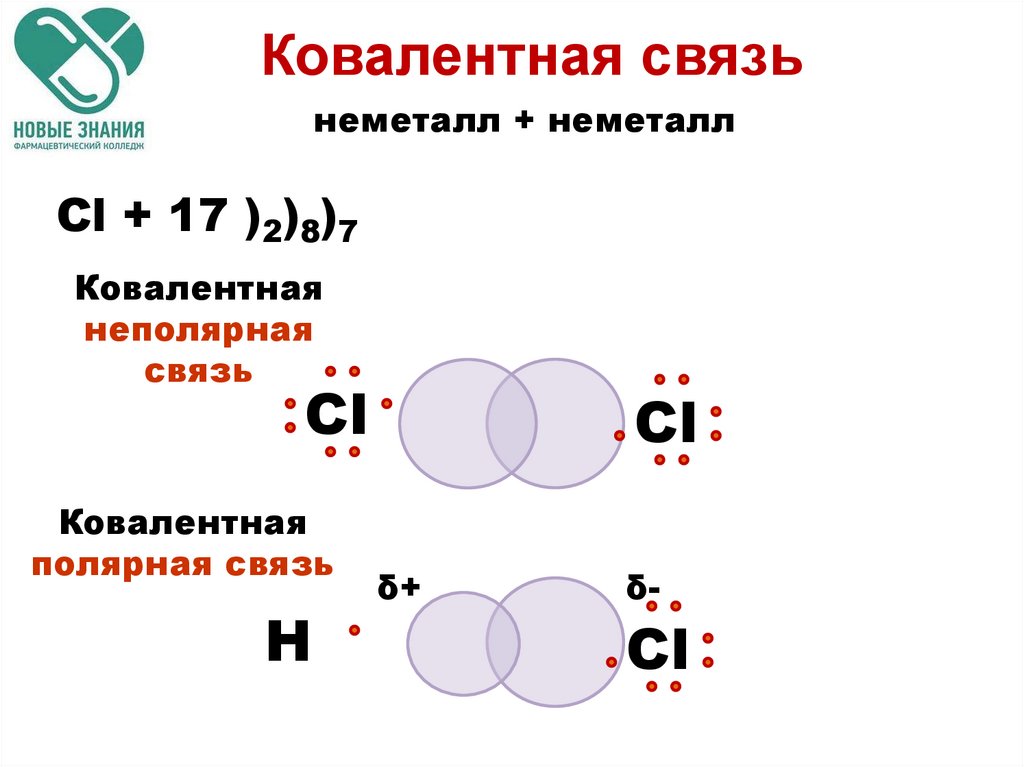
Ковалентная связьнеметалл + неметалл
Cl + 17 )2)8)7
Ковалентная
неполярная
связь
Сl
Ковалентная
полярная связь
Н
Сl
δ+
δ-
Сl
8.
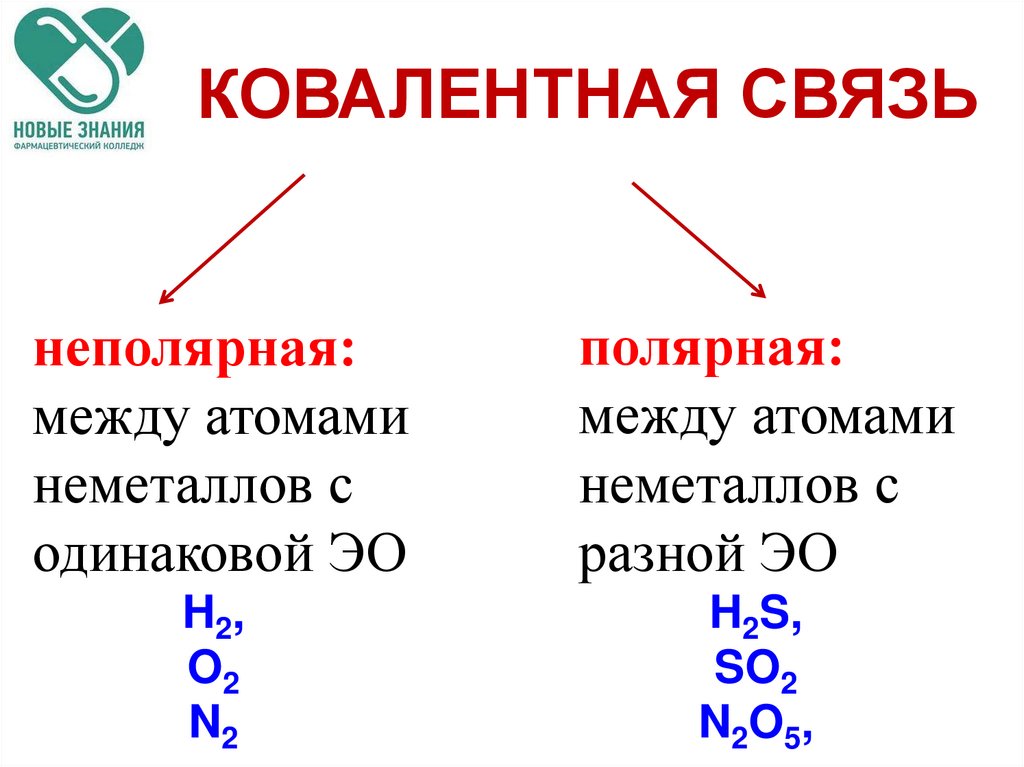
КОВАЛЕНТНАЯ СВЯЗЬнеполярная:
между атомами
неметаллов с
одинаковой ЭО
полярная:
между атомами
неметаллов с
разной ЭО
H 2,
O2
N2
H2S,
SO2
N 2O 5,
9.
ИОННАЯ СВЯЗЬИонная
химическая
связь
электростатическое
взаимодействие отрицательно и
положительно заряженных ионов в
химическом соединении.
+ -
NaCl
10.
Ионная- это связь, котораяобразуется между ионами металла
и неметалла за счет принятия и
отдачи электронов (элементы
значительно отличаются по
электроотрицательности).
11.
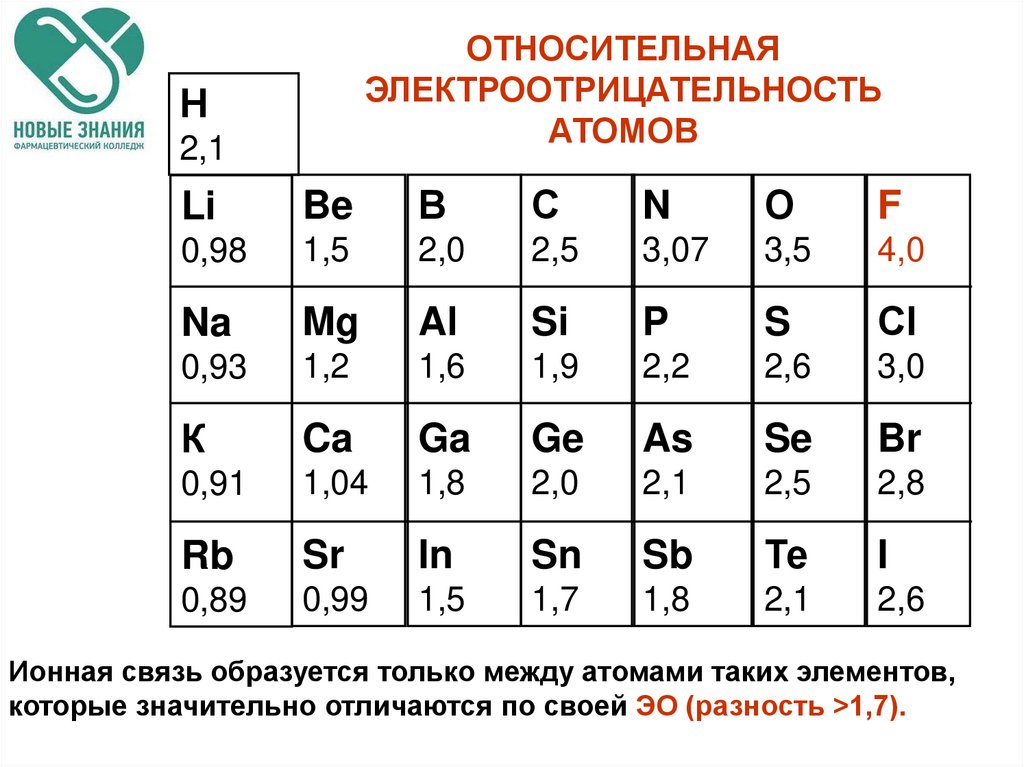
ОТНОСИТЕЛЬНАЯЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
АТОМОВ
Н
2,1
Li
Be
В
С
N
О
F
0,98
1,5
2,0
2,5
3,07
3,5
4,0
Na
Mg
Al
Si
P
S
Сl
0,93
1,2
1,6
1,9
2,2
2,6
3,0
К
Ca
Ga
Ge
As
Se
Br
0,91
1,04
1,8
2,0
2,1
2,5
2,8
Rb
Sr
In
Sn
Sb
Те
I
0,89
0,99
1,5
1,7
1,8
2,1
2,6
Ионная связь образуется только между атомами таких элементов,
которые значительно отличаются по своей ЭО (разность >1,7).
12.
1213.
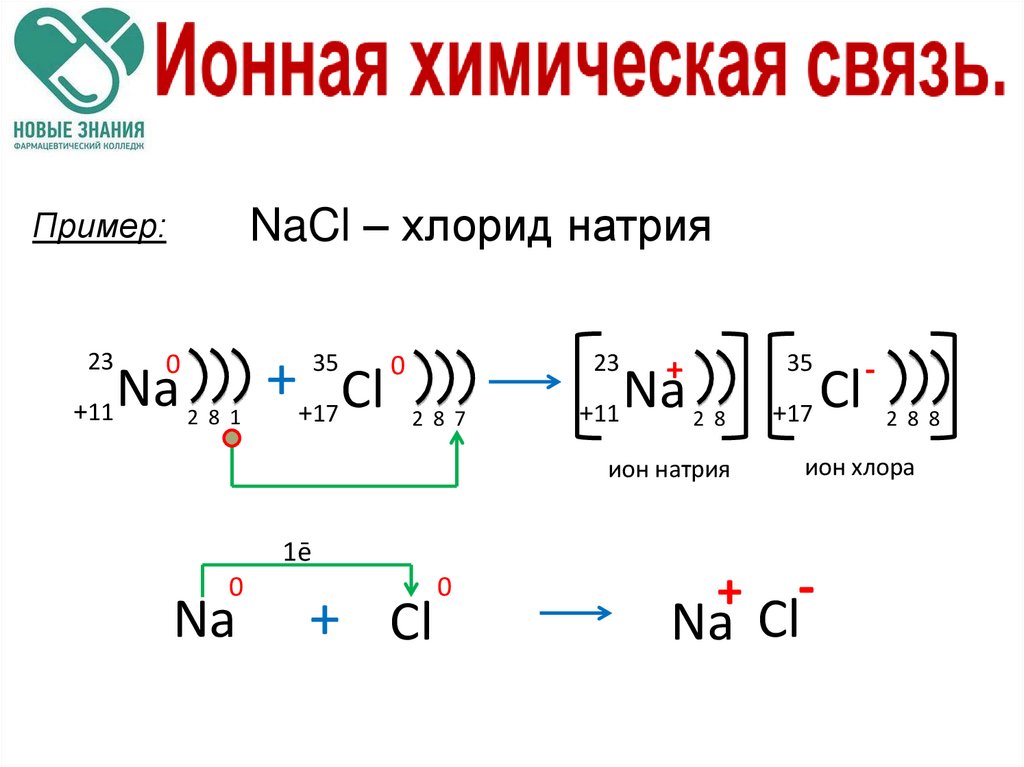
NaCl – хлорид натрияПример:
23
+11
0
Na
++17 Cl
35
2 8 1
23
0
2 8 7
+11
35
+
Na
2 8
ион натрия
1ē
0
Na
+ Cl
0
+17
2 8 8
ион хлора
Na Cl
+
Cl
-
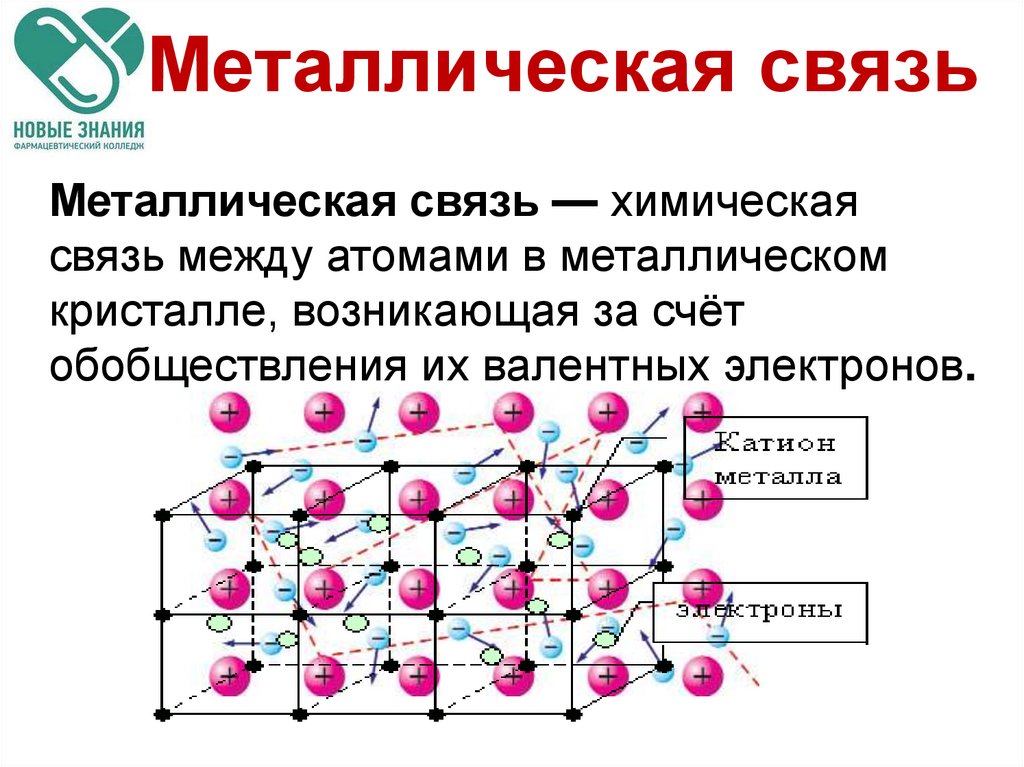
14. Металлическая связь
Металлическая связь — химическаясвязь между атомами в металлическом
кристалле, возникающая за счёт
обобществления их валентных электронов.
15. Металлическая связь
Металлическая кристаллическая решетка и металлическаясвязь определяют такие свойства металлов: ковкость,
пластичность, электро- и теплопроводность,
металлический блеск, способность к образованию сплавов.
http://adamantsteel.ru/
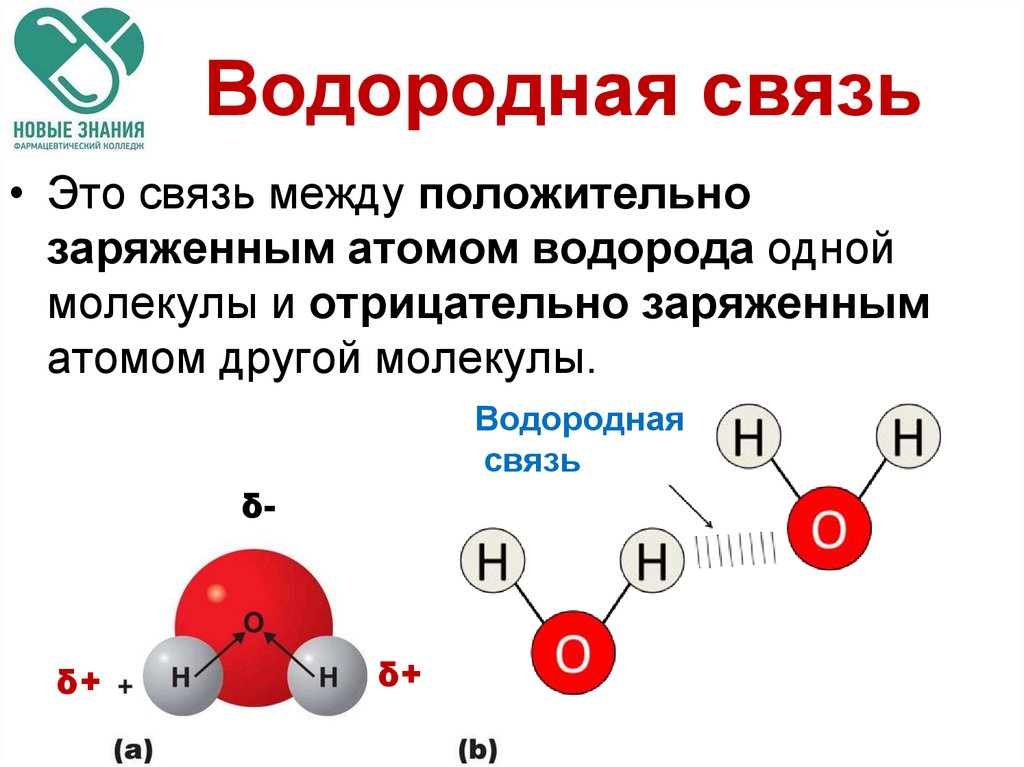
16. Водородная связь
• Это связь между положительнозаряженным атомом водорода одной
молекулы и отрицательно заряженным
атомом другой молекулы.
Водородная
связь
δ-
δ+
δ+
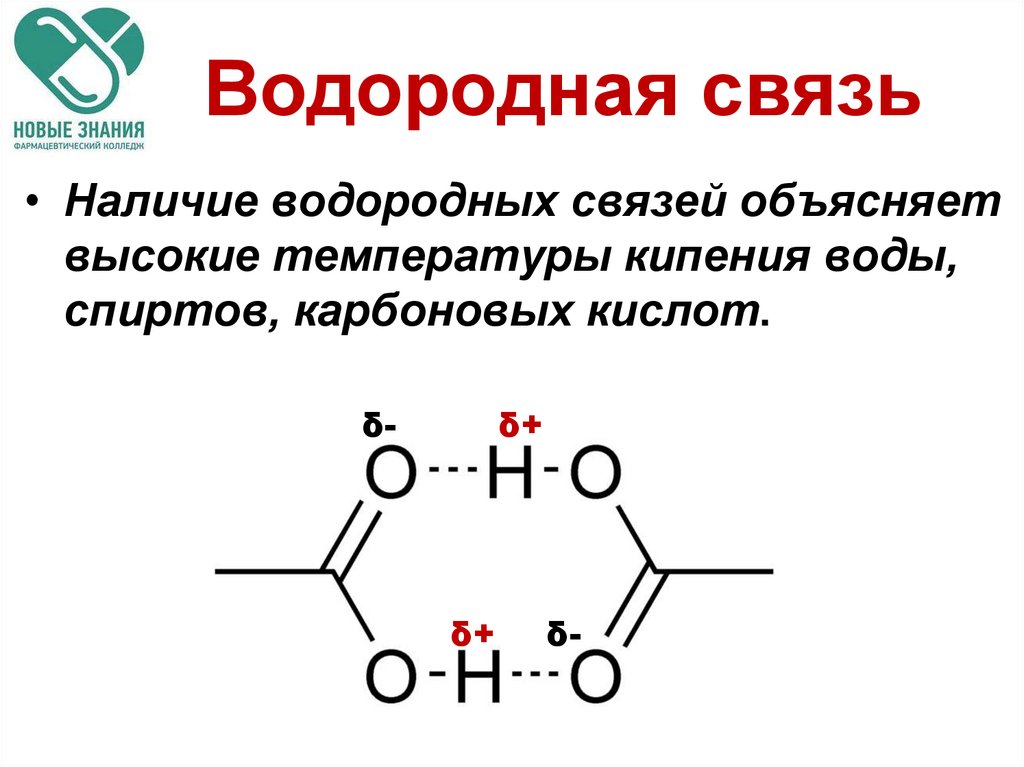
17. Водородная связь
• Наличие водородных связей объясняетвысокие температуры кипения воды,
спиртов, карбоновых кислот.
δ-
δ+
δ+
δ-
18. Механизм образования водородной связи
Электростатическоепритяжение атома
водорода, имеющего
частично положительный
заряд, и атома кислорода
(фтора или азота),
имеющего частично
отрицательный заряд
Н δ+ – Fδ⁻ . . . Hδ+ – F δ-
Донорно-акцепторное
взаимодействие между
почти свободной
орбиталью атома
водорода и
неподеленной
электронной парой
атома азота
19.
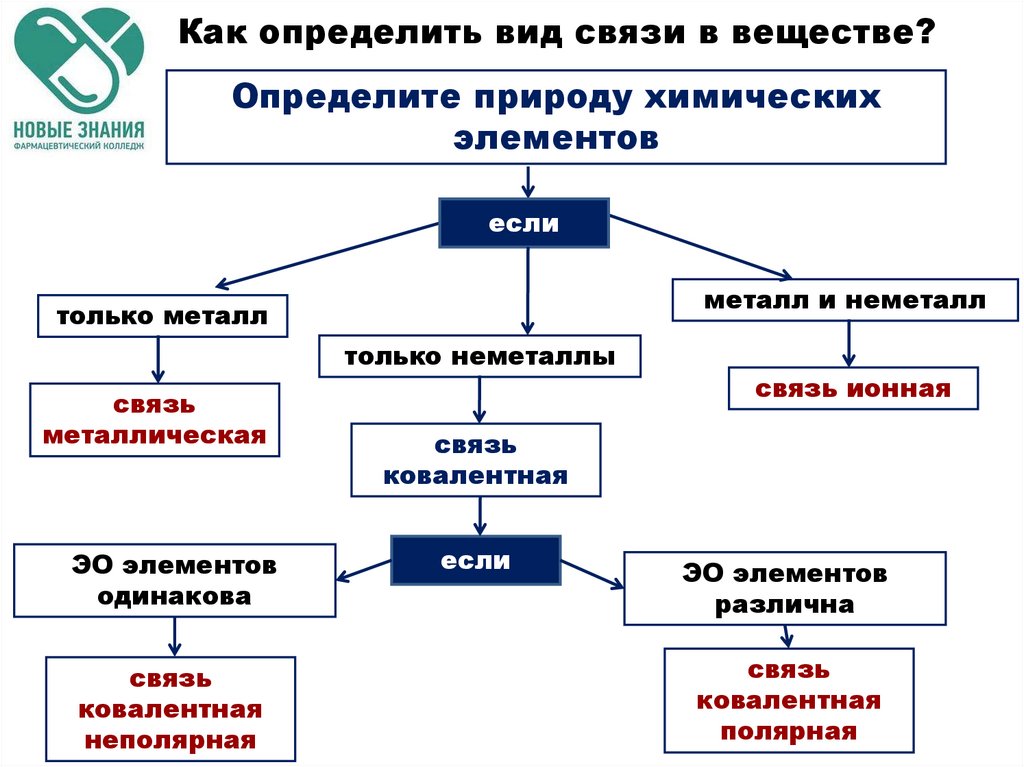
Как определить вид связи в веществе?Определите природу химических
элементов
если
металл и неметалл
только металл
только неметаллы
связь
металлическая
ЭО элементов
одинакова
связь
ковалентная
неполярная
связь ионная
связь
ковалентная
если
ЭО элементов
различна
связь
ковалентная
полярная
20.
ТИПЫХИМИЧЕСКОЙ СВЯЗИ








 Химия
Химия








