Похожие презентации:
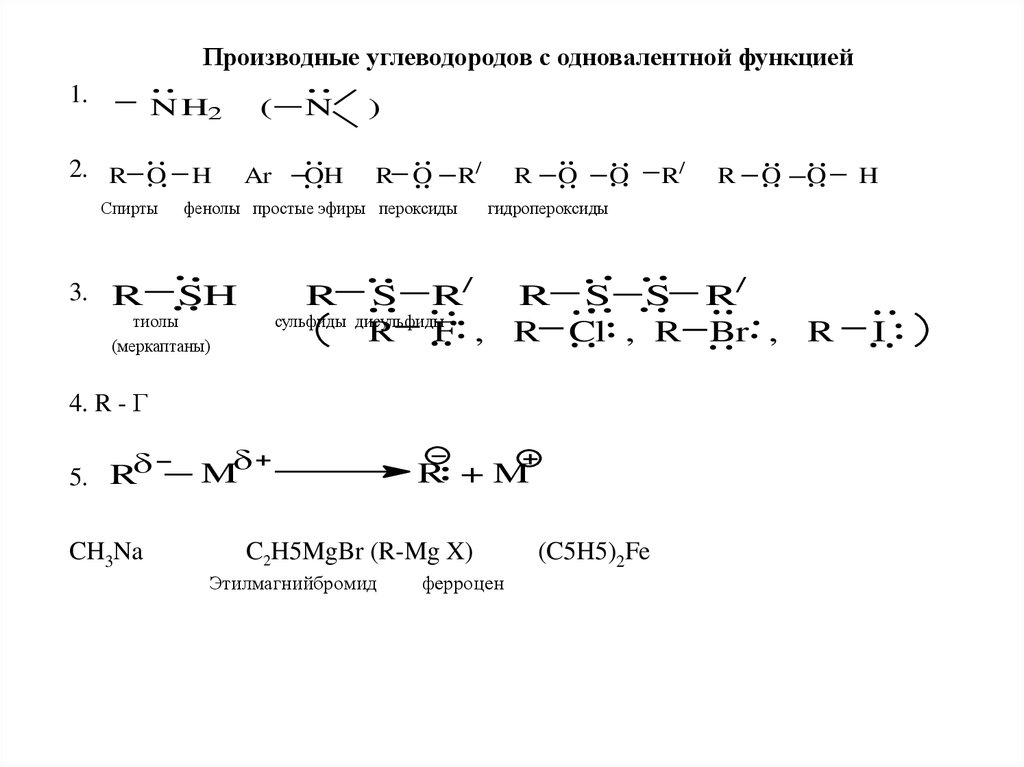
Производные углеводородов с одновалентной функцией
1.
Производные углеводородов с одновалентной функцией1.
N H2
2. R O
Спирты
3. R
H
(
Ar
N
OH
)
R O
R/
фенолы простые эфиры пероксиды
SH
R
тиолы
(меркаптаны)
сульфиды
R
O
O
CH3Na
R
O
O
S R/
R S S R/
дисульфиды
R F , R Cl , R Br , R
M
R +M
C2H5MgBr (R-Mg X)
Этилмагнийбромид
H
гидропероксиды
4. R - Г
5. R
R/
ферроцен
(C5H5)2Fe
I
2.
Примеры галогенопроизводных, используемых в медицинской практикеНазвание,
формула
Применение
CH3CH2Cl
хлористый этил
местноанестезирующее действие
CHCl3
хлороформ
средство для ингаляционного
наркоза
CH I3
йодоформ
антисептическое средство
CF3CHClBr
фторотан
летучий ингаляционный наркотик
ClCH = CCl2
трихлорэтилен
наркотическое средство
3.
Кислотно-основные свойства соединений.AH
B
Base
R
O
H
R
O
H
R
S
H
R
S
H
R
NH
H
R
N
R
C
H
R
O
R/
R
S
R/
По теории Беренстеда –Лоури кислоты - доноры протонов, основания – акцепторы
протонов.
В зависимости от природы элемента, с которым связан протон, бренстедовские кислоты
делятся на четыре типа:
O-H кислоты: карбоновые кислоты, фенолы, спирты;
S-H кислоты: тиолы;
N-H кислоты: амиды, амины, имиды;
C-H кислоты: углеводороды и их производные.
AH
Кислота
+
B
A
+
BH
Основание Сопряженное Сопряженная
основание
кислота
Сравнительный анализ силы кислот (оснований) проводят путем сопоставления
стабильности (устойчивости) соответствующих сопряженных оснований (кислот)
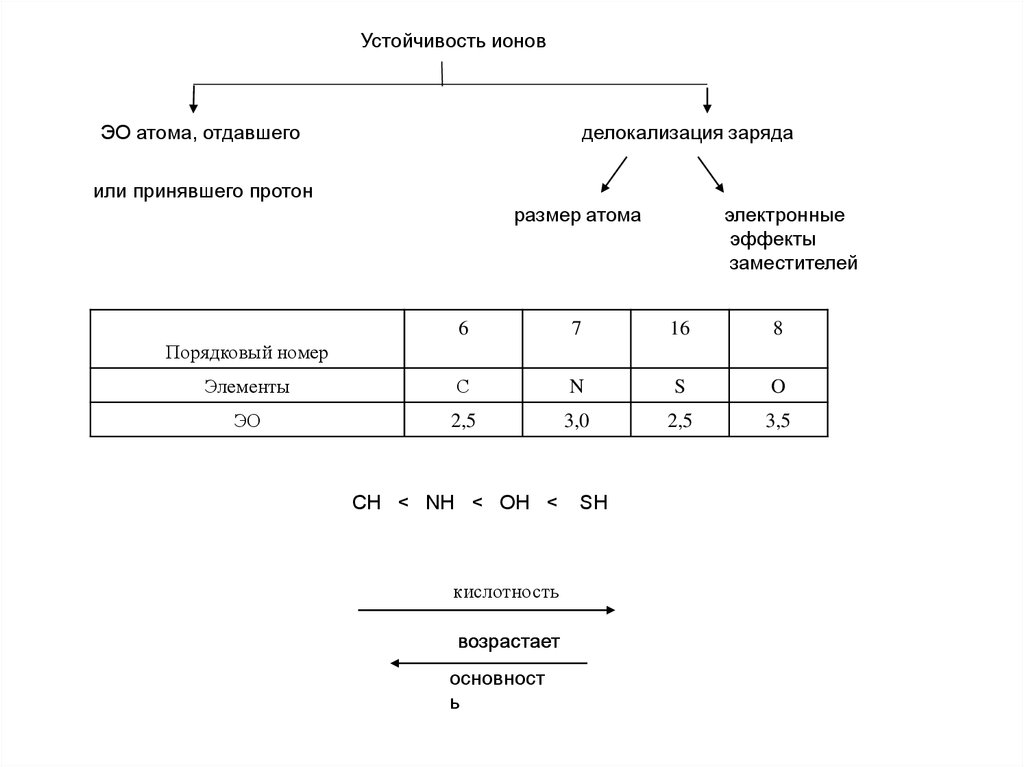
4.
Устойчивость ионовЭО атома, отдавшего
делокализация заряда
или принявшего протон
размер атома
электронные
эффекты
заместителей
6
7
16
8
Элементы
С
N
S
O
ЭО
2,5
3,0
2,5
3,5
Порядковый номер
CH < NH < OH <
кислотность
возрастает
основност
ь
SH
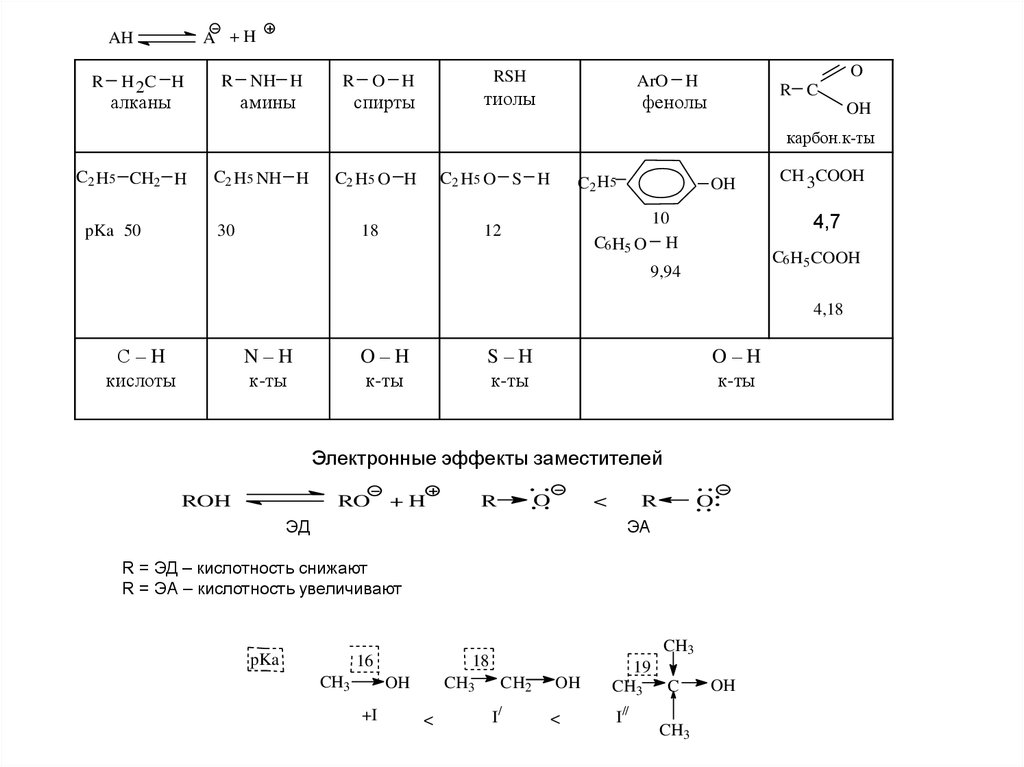
5.
A +HAH
R
H 2C H
R NH H
алканы
R
амины
O
RSH
H
ArO
тиолы
спирты
O
H
R C
фенолы
OH
карбон.к-ты
C2 H5 CH2 H
pKa 50
C2 H5 NH H
C2 H5 O H
30
C2 H5 O S H
18
C2 H5
OH
10
C6 H5 O H
12
CH 3COOH
4,7
C6 H5 COOH
9,94
4,18
С–H
кислоты
N–H
к-ты
O–H
к-ты
S–H
к-ты
O–H
к-ты
Электронные эффекты заместителей
ROH
RO
+H
O
R
<
ЭД
R
O
ЭА
R = ЭД – кислотность снижают
R = ЭА – кислотность увеличивают
pKa
16
CH3
OH
+I
CH3
18
CH3
<
CH2
I/
OH
<
19
CH3 C
I//
CH3
OH
6.
Уменьшение кислотных свойствКа
Эффект
Соединение
H
O H
C H3
O H
-
10
-16
10
-17
+I CH3
10 -12
- I CСl3
10 -10
+ M OH
Cl
Cl
C
O H
C H2
Cl
O
O2N
H
O H
10 -7
+ M OH, - I NO2
7.
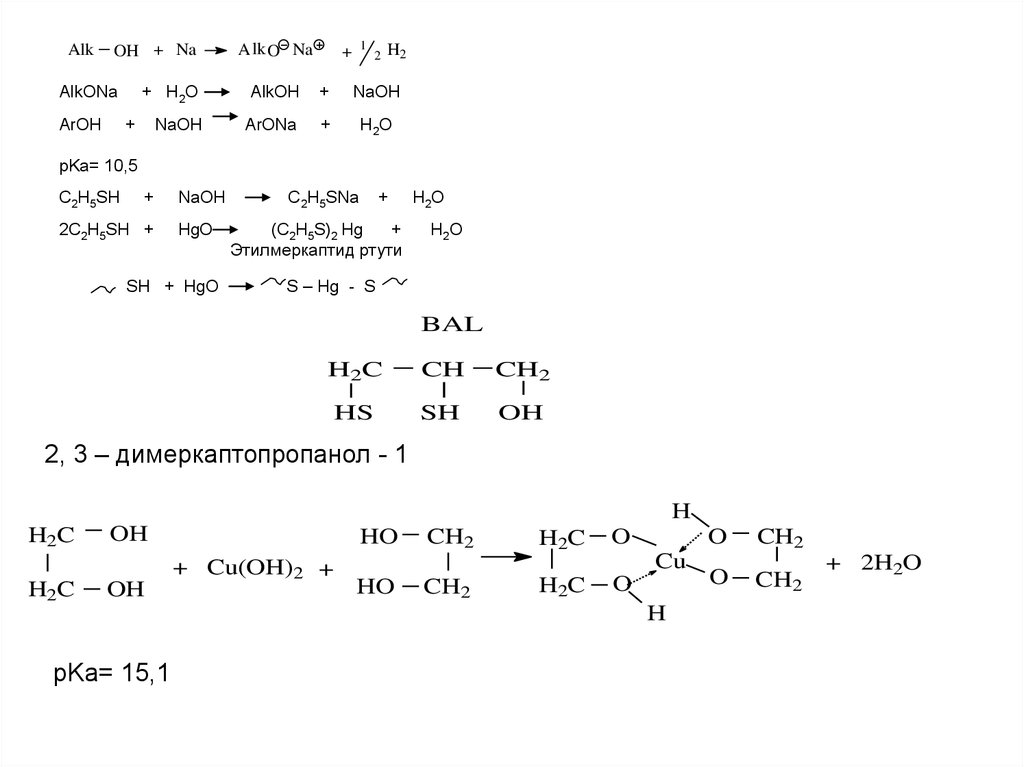
AlkOH + Na
AlkONa
ArOH
A lk O Na
1
+
2
H2
+ H2O
AlkOH
+
NaOH
NaOH
ArONa
+
H2O
+
pKa= 10,5
C2H5SH
+
2C2H5SH +
NaOH
HgO
SH + HgO
C2H5SNa
+
(C2H5S)2 Hg
+
Этилмеркаптид ртути
H2O
H2O
S – Hg - S
BAL
H2C
CH
CH2
HS
SH
OH
2, 3 – димеркаптопропанол - 1
H
H2C
H2C
OH
OH
HO
+ Cu(OH)2 +
CH2
H2C
O
Cu
HO
CH2
H2C
O
H
pKa= 15,1
O
CH2
O
CH2
+ 2H2O
8.
Основные свойстваC=C
+ H
C = C
H
+ H
П - основания
H
n – основание
( ониевые)
N
R
R
R
O
>>
>>
N
N
N
O
O
S
Hal
R3 N
N
>
R O
R
R3 P
радиус основность
ОЭО
основность
B
NH3 + H
NH4
BH
pKNH4+= 9,26
9.
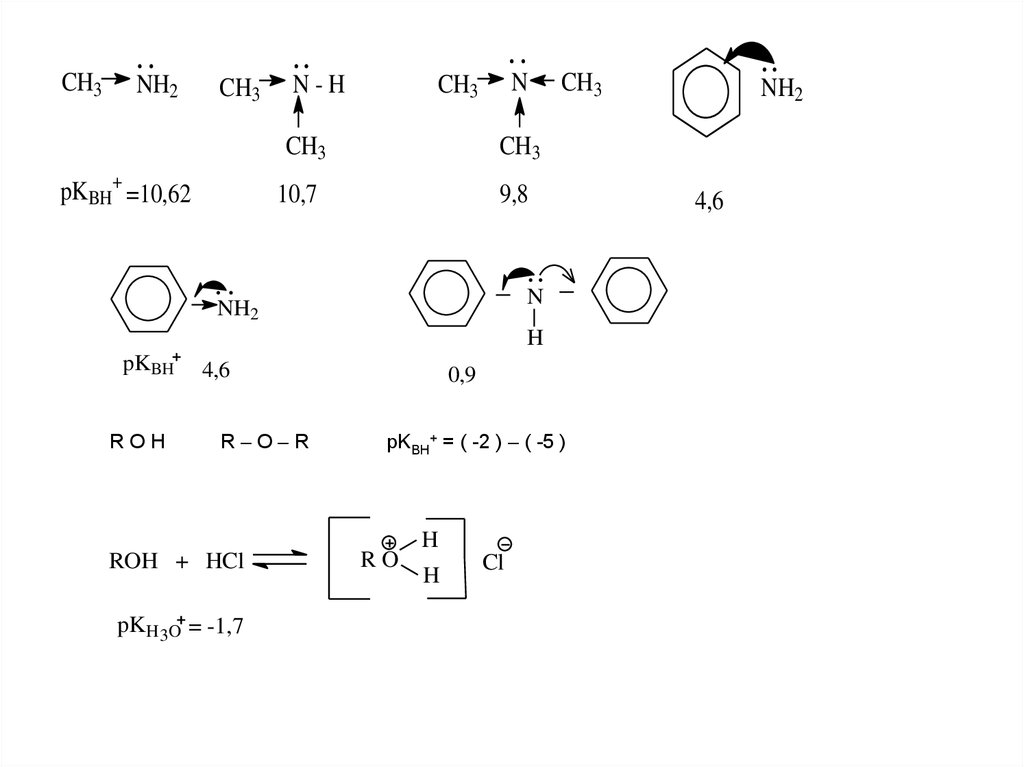
CH3NH2
CH3
N-H
CH3
pKBH+ =10,62
N
CH3
CH3
CH3
10,7
9,8
N
NH2
H
pKBH
ROH
4,6
R–O–R
ROH + HCl
pKH 3O = -1,7
NH2
0,9
pKBH+ = ( -2 ) – ( -5 )
RO
H
H
Cl
4,6
10.
Реакции нуклеофильного замещенияSN
Nu
+
C
X
( sp3 - )
Nu - C
+ X
уходящая группа
Нуклеофил
Продукт реакции с R - X
RSH тиолы
SH
R - S - R тиоэфиры
SR
R - O - R простые эфиры
OR
OH
R - OH спирты
H 2O
RГ галогенопроизводные
Cl , Br , I
RNH2 амины
NH3
Hal ,
H2O , ROH
Хорошо уходящая группа
HO , RO , NH2 , H , CH3
Плохо уходящая группа
(сильные основания)
11.
Способность к SN реакциям зависит от факторов:C
1) полярность связи
C - NH2
<<
C
OH
X
<<
C
Hal
электроотрицательность
+М
2) легкость разрыва C X связи
C
I
>
C
Br
>
C
Cl
>
C
F
3) возможности делокализации положительного заряда в карбкатионе в SN1
реакциях
H2O
CH2 = CH - CH2Cl
CH2 = CH - CH2OH
OH
- Cl
CH2 = CH - CH2
CH2 CH
CH2
CH2 - CH = CH2
SN2
СH3CH2Br + NaOH
CH3CH2OH + NaBr
CH3
HO
SN1
+
R
R
R
C
H
H
C
Br
медл.
CH3
Br
HO
C
H
Br
HO
C
H
R3C + Br , 2) R3C + OH
R3C OH
CH3
H + Br
H
12.
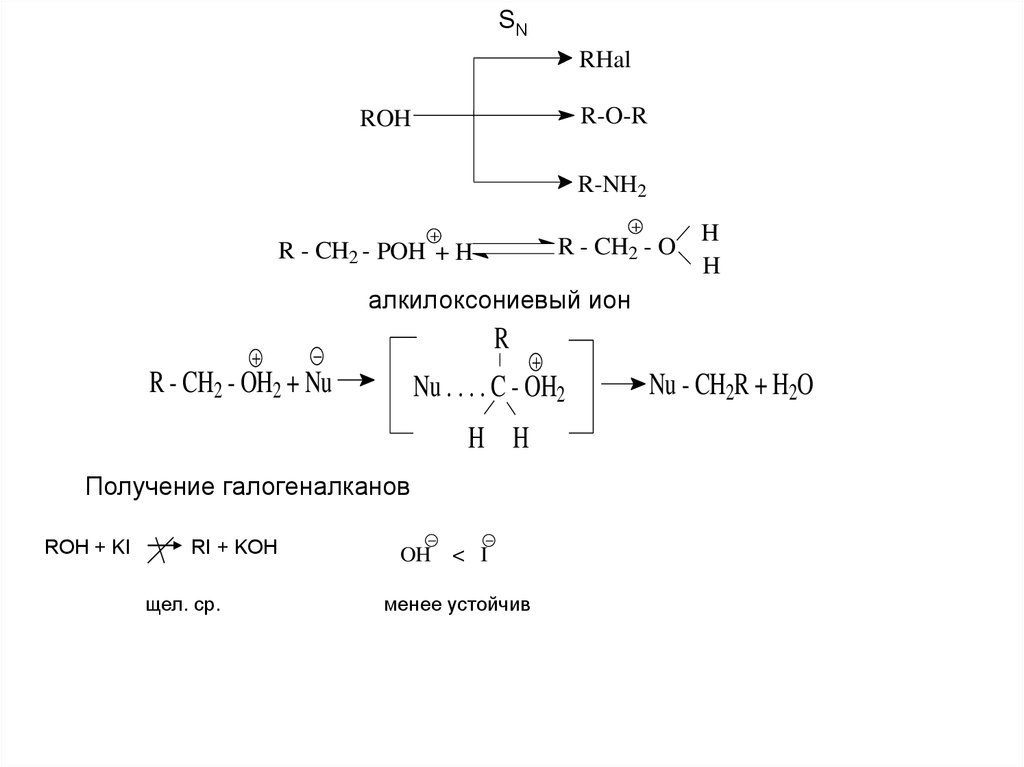
SNRHal
R-O-R
ROH
R-NH2
R - CH2 - O
R - CH2 - POH + H
H
H
алкилоксониевый ион
R
R - CH2 - OH2 + Nu
Nu . . . . C - OH2
H H
Получение галогеналканов
ROH + KI
RI + KOH
щел. ср.
OH < I
менее устойчив
Nu - CH2R + H2O
13.
Кислая средаCH3OH + HI
CH3OH2
+ HBr
+I
CH3Br
HI > HBr > HCl > HF
ROH + HCl
PCl3,
PCl5,
B3 ROH + PCl3
ROH + PCl5
RCl + H2O
SOCl2
3RCl + H3PO3
RCl + POCL3 + HCl
CH3I + H2O
14.
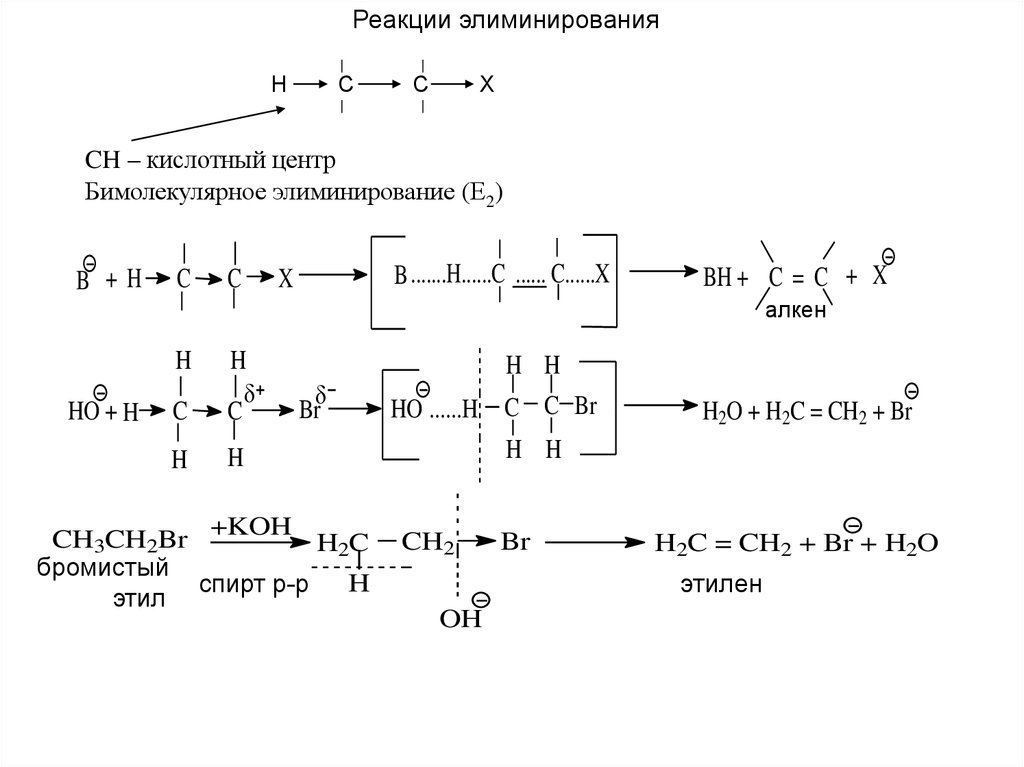
Реакции элиминированияH
C
C
X
CH – кислотный центр
Бимолекулярное элиминирование (Е2)
B +H
C
C
B .......H......C ...... C......X
X
BH + C = C + X
алкен
H
HO + H
C
H
C
H
H
Br
+KOH
CH3CH2Br
H2C
бромистый
H
спирт р-р
этил
H H
HO ......H C C Br
H2O + H2C = CH2 + Br
H H
CH2
Br
H2C = CH2 + Br + H2O
этилен
OH
15.
Реакция дегидрогалогенирования, дегидратацииH3C
H3C
CH
CH
Cl
CH3
to, NaOH
-NaCl
-H2O
CH3
CH3
CH3
CH3
Правило Зайцева
C = CH
CH3
основной продукт
CH
CH = CH2
побочный продукт








 Химия
Химия








