Похожие презентации:
Классификация электродов. (Лекция 4)
1.
2016Лекция 4
1
2.
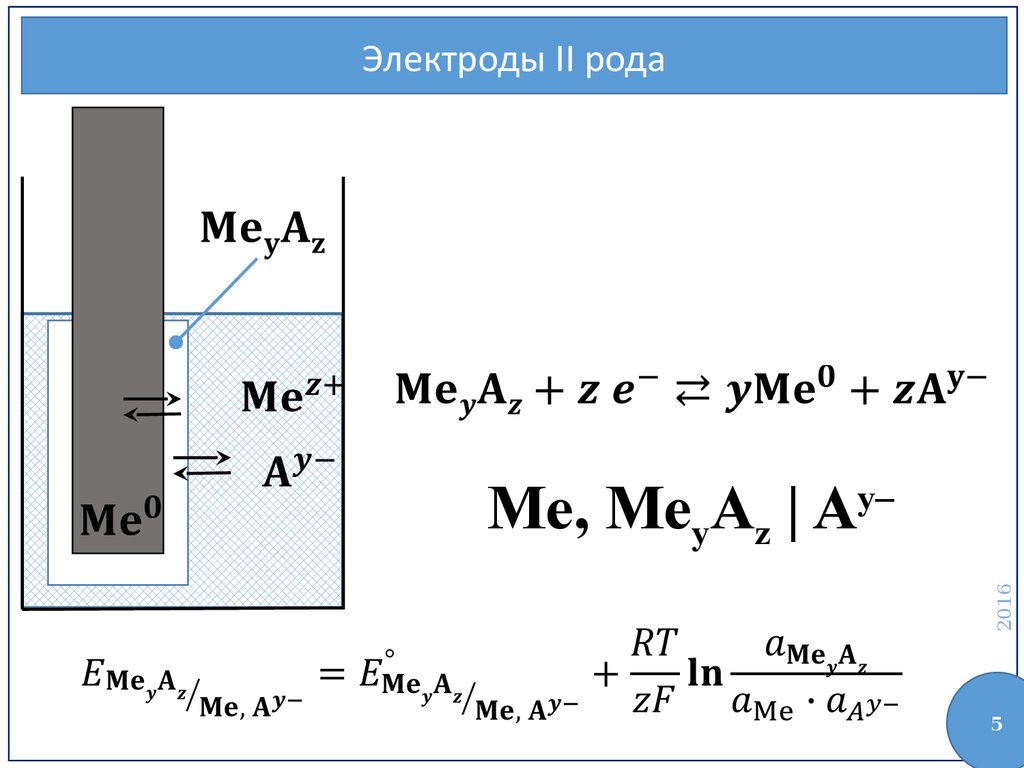
Классификация электродовЭлектроды II рода
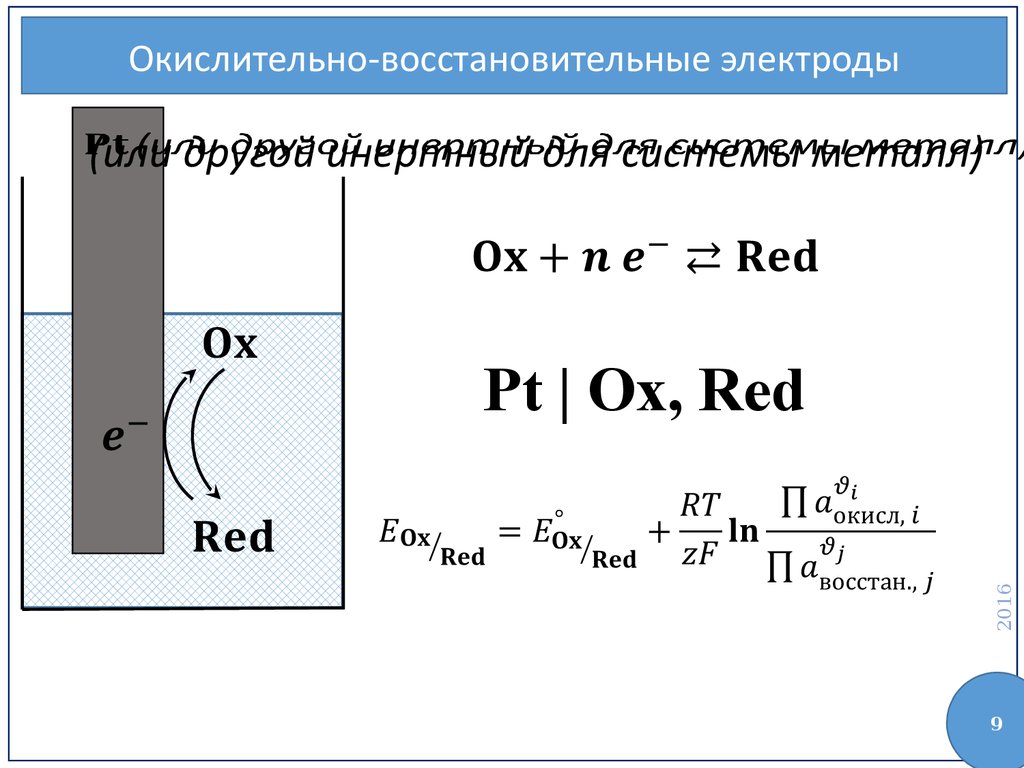
Окислительновосстановительные
2016
Электроды I рода
2
3.
Me | Mez+2016
Электроды I рода
3
4.
Электроды I родаCu в растворе CuSO4
:
2016
Cu | Cu
2+
4
5.
Электроды II рода2016
Me, MeyAz | Ay–
5
6.
Хлорсеребряный электрод2016
Ag, AgCl | Cl–
— электрод сравнения
6
7.
Хлорсеребряный электродРаствор KCl
Ag, AgCl | KClнас.
При 298 К и с насыщенным раствором KCl
В
2016
Ag, AgCl
7
8.
Электроды II родаОксидно-ртутный электрод
2016
Hg, HgO | OH
–
8
9.
Окислительно-восстановительные электроды(или другой инертный для системы металл)
2016
Pt | Ox, Red
9
10.
Окислительно-восстановительные электроды2016
Pt | Fe3+, Fe2+
10
11.
Окислительно-восстановительные электроды2016
Pt |
11
12.
Хингидронный электрод2016
Pt |
— индикаторный электрод для измерения pH
12
13.
Водородный электродПри =1 атм и T = 298 К
— индикаторный электрод для измерения pH
— электрод сравнения при , =1 атм
2016
Pt ,
13
14.
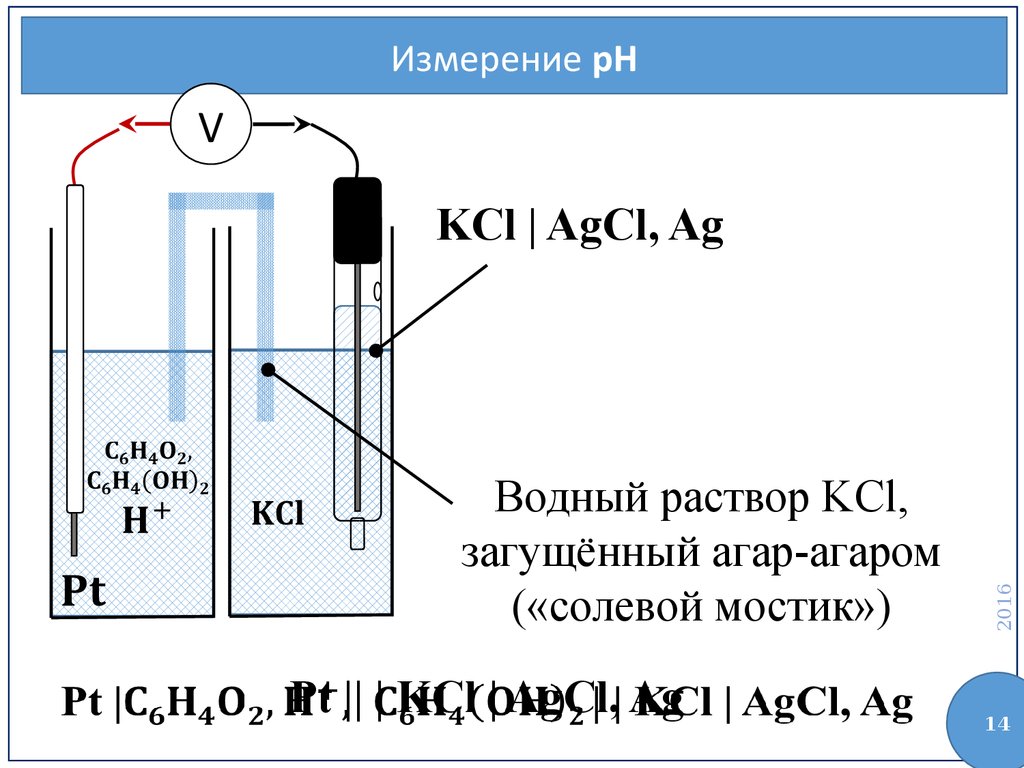
Измерение pHV
Водный раствор KCl,
загущённый агар-агаром
(«солевой мостик»)
Pt || | KCl | AgCl, Ag
2016
KCl | AgCl, Ag
14
15.
Измерение pHPt || | KCl | AgCl, Ag
2016
⇒ ⇒
⇒
15
16.
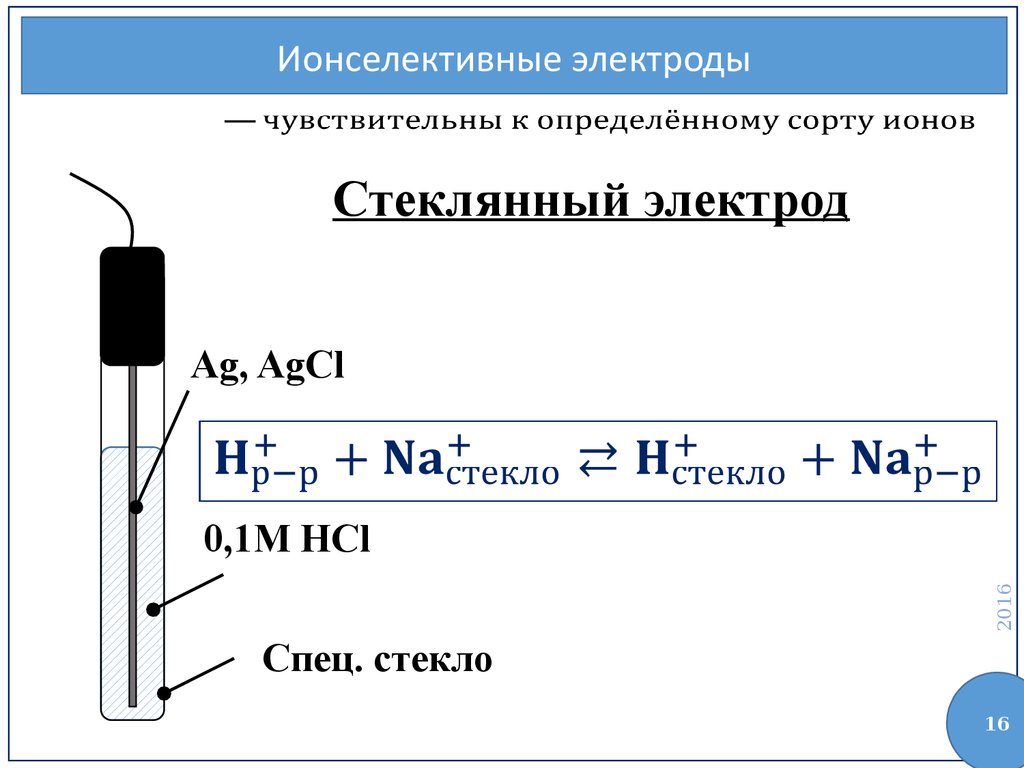
Ионселективные электродыСтеклянный электрод
Ag, AgCl
2016
0,1M HCl
Спец. стекло
16
17.
ДляДля
2016
Стеклянный электрод
17
18.
Ионселективные электродыЕсть стеклянные электроды, селективные к
ионам: Na+, K+, Li+, Cs+, NH4+, Ag+, Tl+,
органическим катионам
2016
Есть мембранные электроды, селективные к
ионам: Ca2+, Mg2+, Pb2+, La3+, Cl–, Br–, I–, NO3– и
др.
18
19.
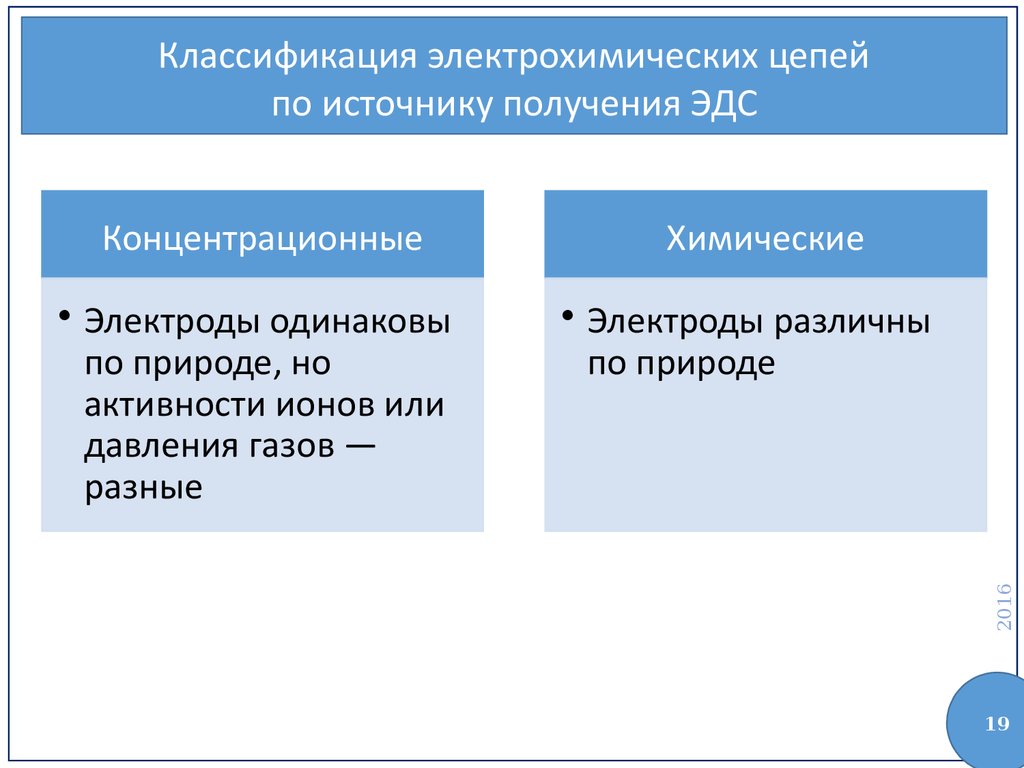
Классификация электрохимических цепейпо источнику получения ЭДС
• Электроды одинаковы
по природе, но
активности ионов или
давления газов —
разные
Химические
• Электроды различны
по природе
2016
Концентрационные
19
20.
Химическая кинетика2016
— изучает закономерности протекания
химических процессов во времени
20
21.
Основные понятия химической кинетикиСкорость химической реакции — …
Для гомогенных реакций:
;
2016
Для гетерогенных реакций:
21
22.
Основные понятия химической кинетикиЕсли V (или S) = const —
В формуле:
“+” — для веществ, концентрация которых
прибывает ( ) — продуктов реакции
“–” — для веществ, концентрация которых убывает
( ) — исходных веществ
2016
Скорость химической реакции — положительна!
22
23.
Основные понятия химической кинетикиСкорость химической реакции общая и по веществу
Общая скорость:
2016
Скорости по веществам:
23
24.
Основные понятия химической кинетикиСкорость химической реакции общая и по веществу
Скорости по веществам:
,
2016
Общая скорость:
24
25.
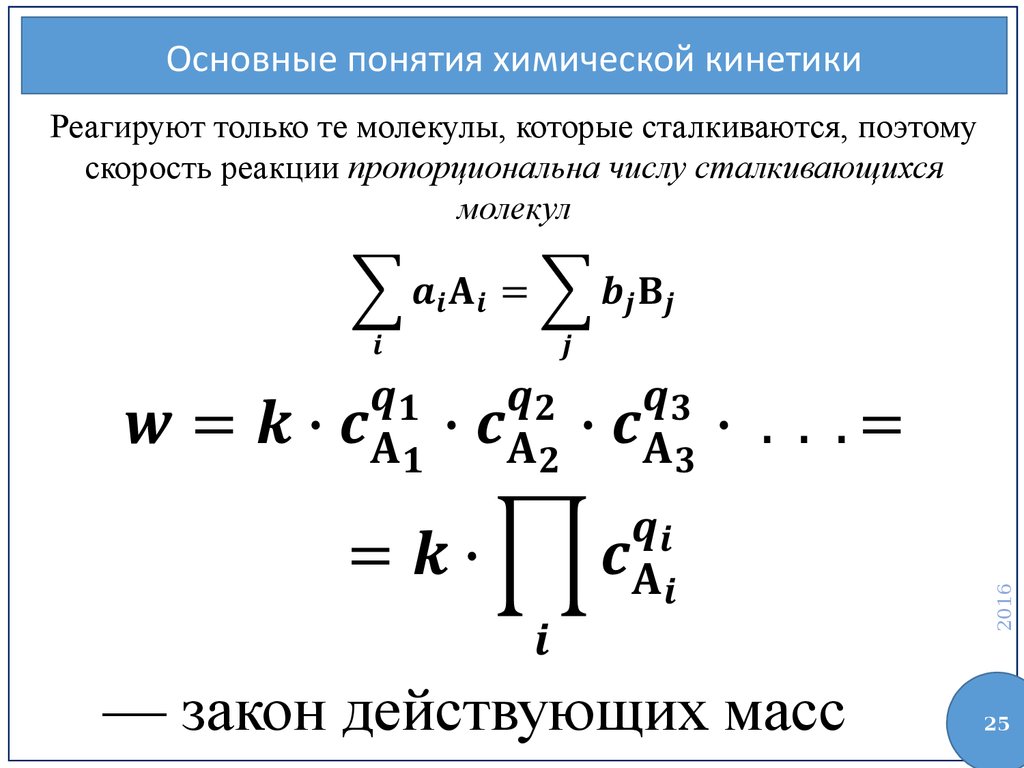
Основные понятия химической кинетики2016
Реагируют только те молекулы, которые сталкиваются, поэтому
скорость реакции пропорциональна числу сталкивающихся
молекул
— закон действующих масс
25
26.
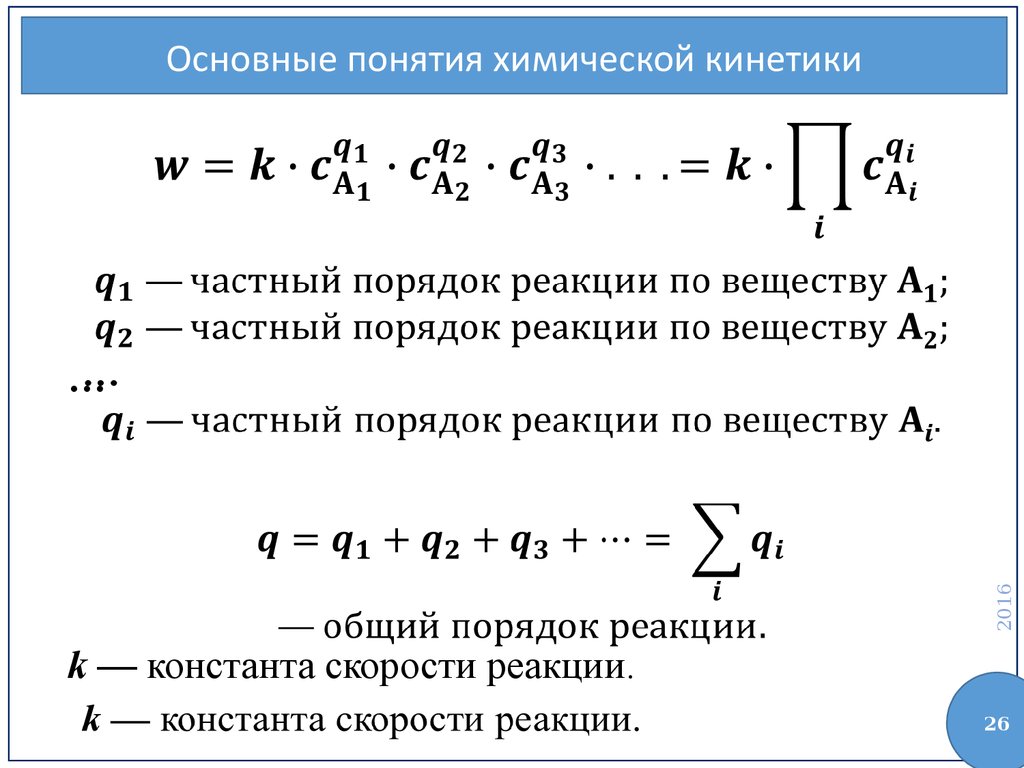
Основные понятия химической кинетики2016
…
k — константа скорости реакции.
26
27.
Основные понятия химической кинетикиk — константа скорости реакции — скорость
реакции при концентрациях реагирующих веществ,
равных единице.
2016
Размерность k — зависит от общего порядка
реакции!
27
28.
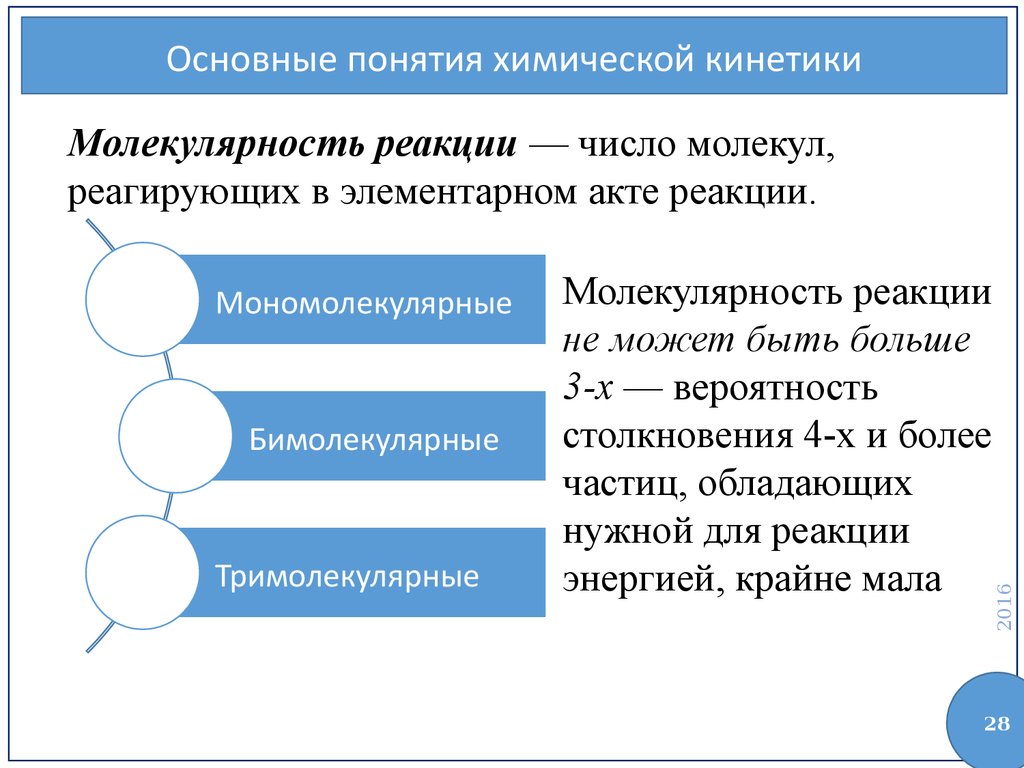
Основные понятия химической кинетикиМономолекулярные
Бимолекулярные
Тримолекулярные
Молекулярность реакции
не может быть больше
3-х — вероятность
столкновения 4-х и более
частиц, обладающих
нужной для реакции
энергией, крайне мала
2016
Молекулярность реакции — число молекул,
реагирующих в элементарном акте реакции.
28
29.
Основные понятия химической кинетикиВ общем случае частные порядки и
стехиометрические коэффициенты принимают
разные значения.
2016
Общий порядок реакции может совпадать с
молекулярностью, если реакция простая и
протекает точно согласно уравнению, только в
этом случае частные порядки совпадают со
стехиометрическими коэффициентами.
29
30.
Кинетика простых химических реакцийПростые химические реакции — реакции, необратимо
протекающие в одну стадию.
Для простой химической реакции с общим порядком q:
2016
— уравнение для скорости в дифференциальной форме;
30
31.
2016Кинетика простых химических реакций
31
32.
2016Кинетика простых химических реакций
32
33.
2016Кинетика простых химических реакций
33
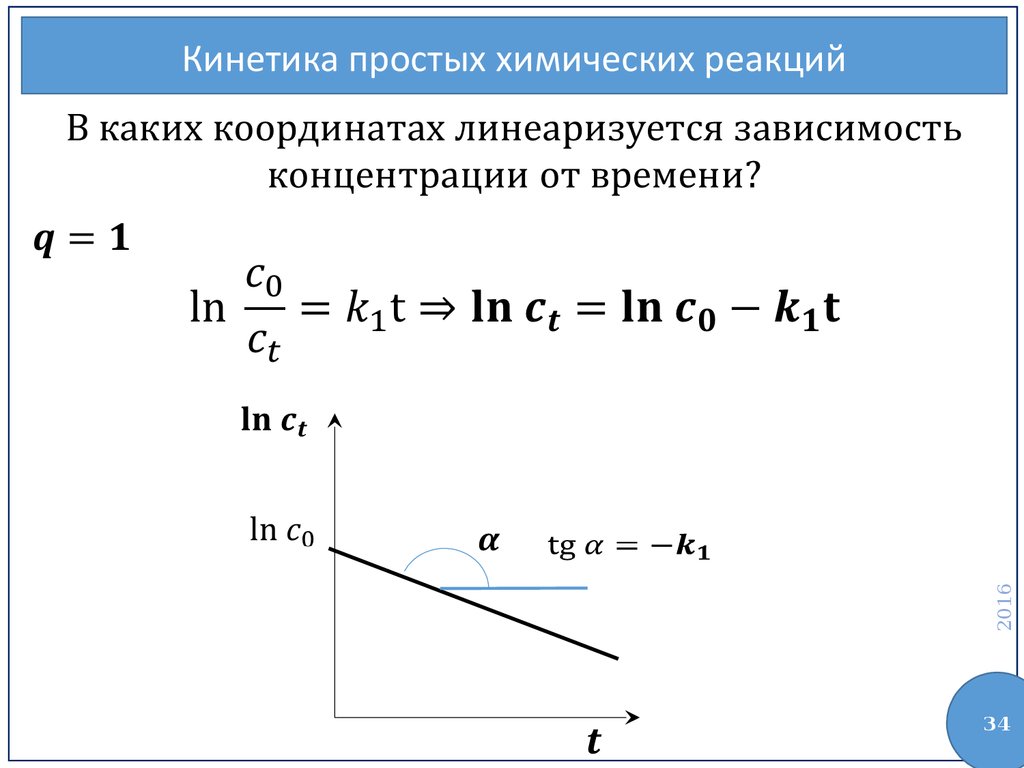
34.
2016Кинетика простых химических реакций
34
35.
Кинетика простых химических реакций2016
прореагирует половина исходного количества вещества
35
36.
Кинетика простых химических реакций2016
прореагирует половина исходного количества вещества
36
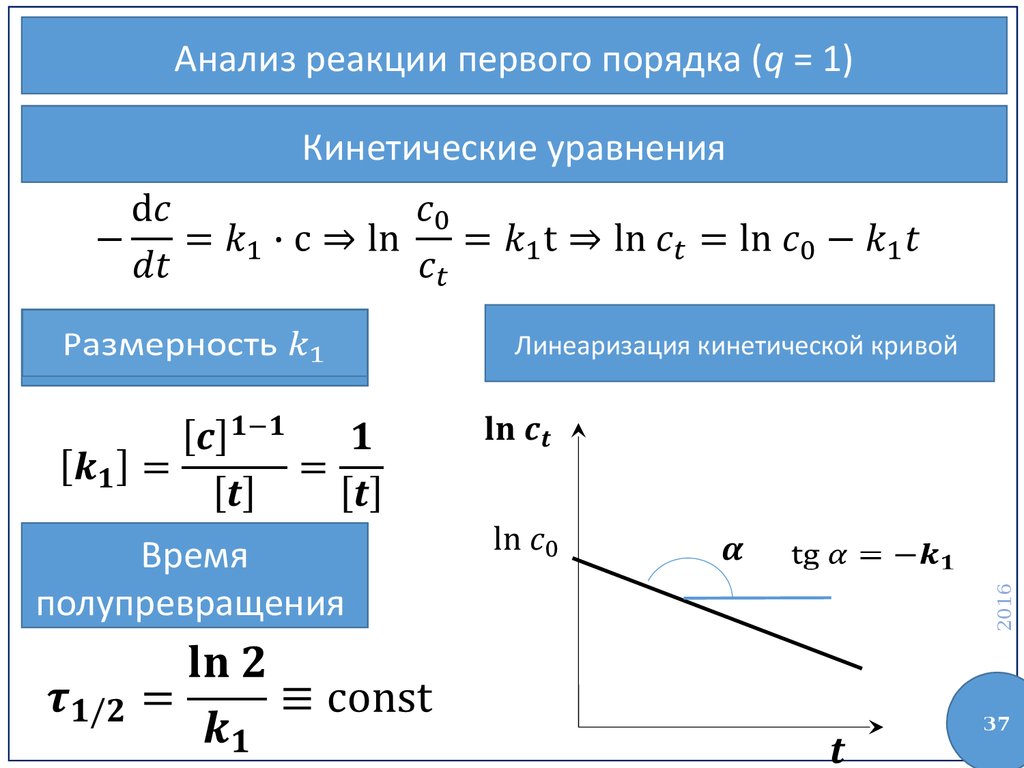
37.
Анализ реакции первого порядка (q = 1)Кинетические уравнения
Время
полупревращения
Линеаризация кинетической кривой
2016
Размерность
37
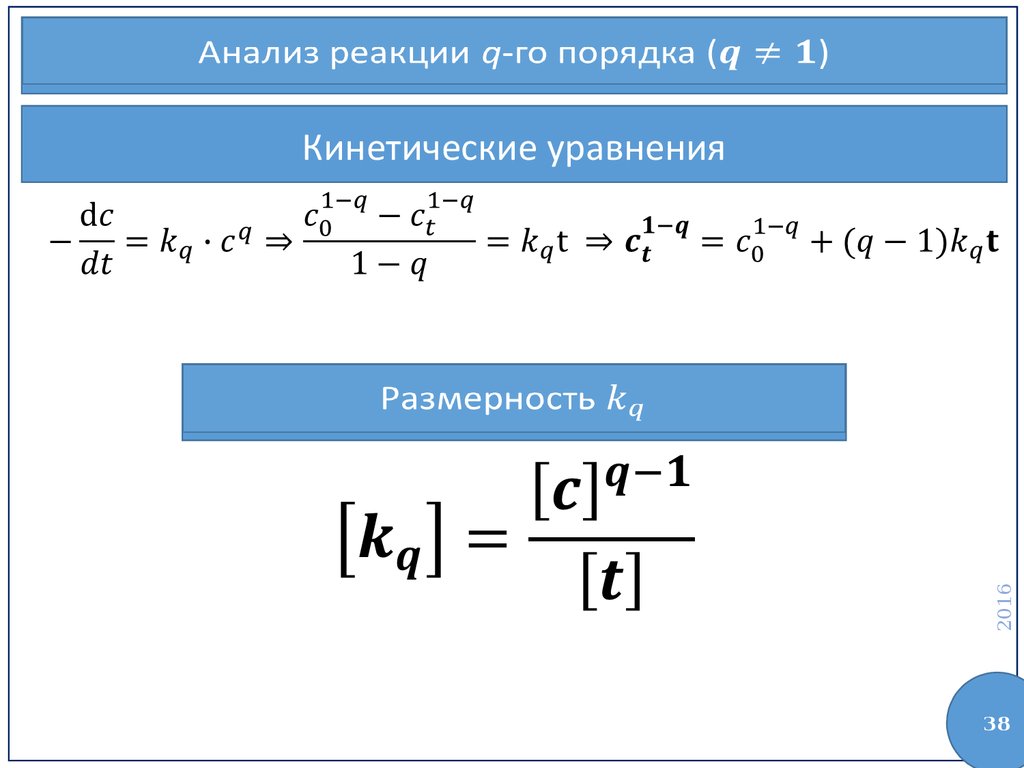
38.
Анализ реакции q-го порядка ()Кинетические уравнения
2016
Размерность
38
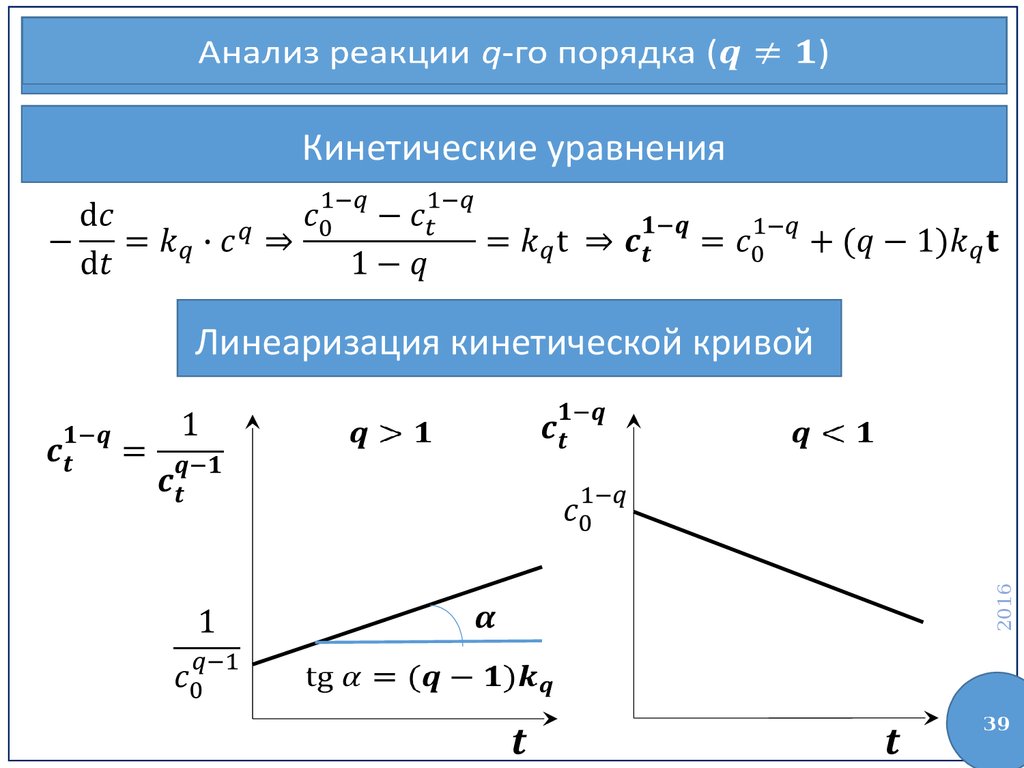
39.
Анализ реакции q-го порядка ()Кинетические уравнения
2016
Линеаризация кинетической кривой
39
40.
Анализ реакции q-го порядка ()Кинетические уравнения
2016
Время полупревращения
40
41.
Анализ реакции 0-го порядка (q = 0)Кинетические уравнения
2016
Размерность
41
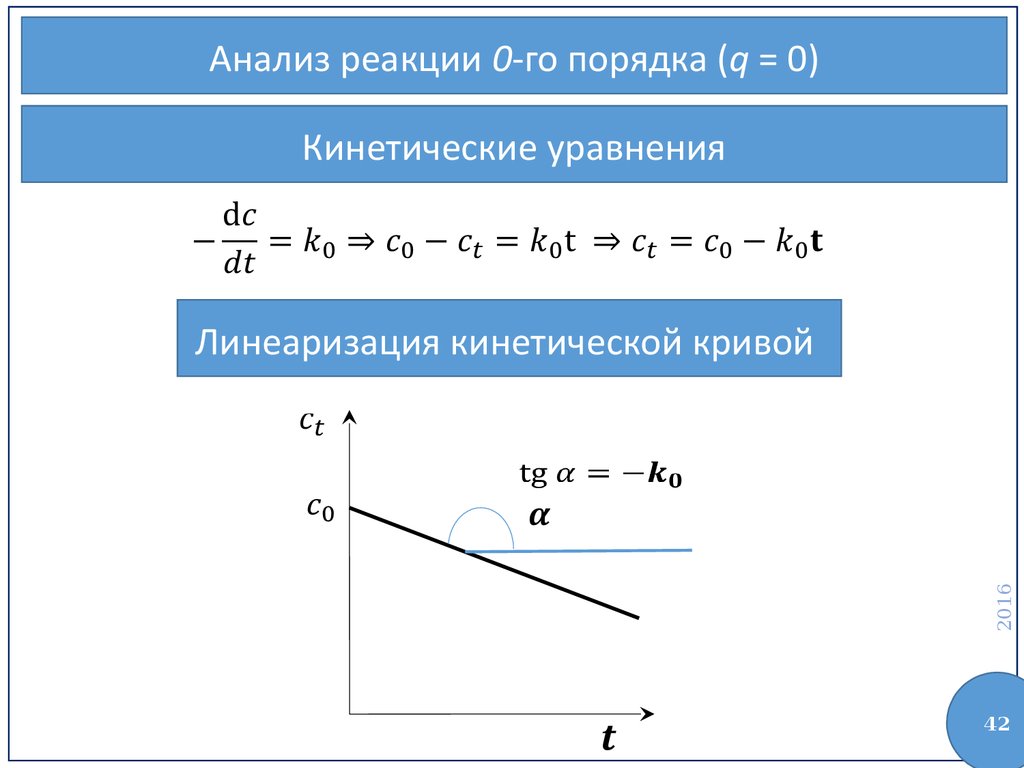
42.
Анализ реакции 0-го порядка (q = 0)Кинетические уравнения
2016
Линеаризация кинетической кривой
42
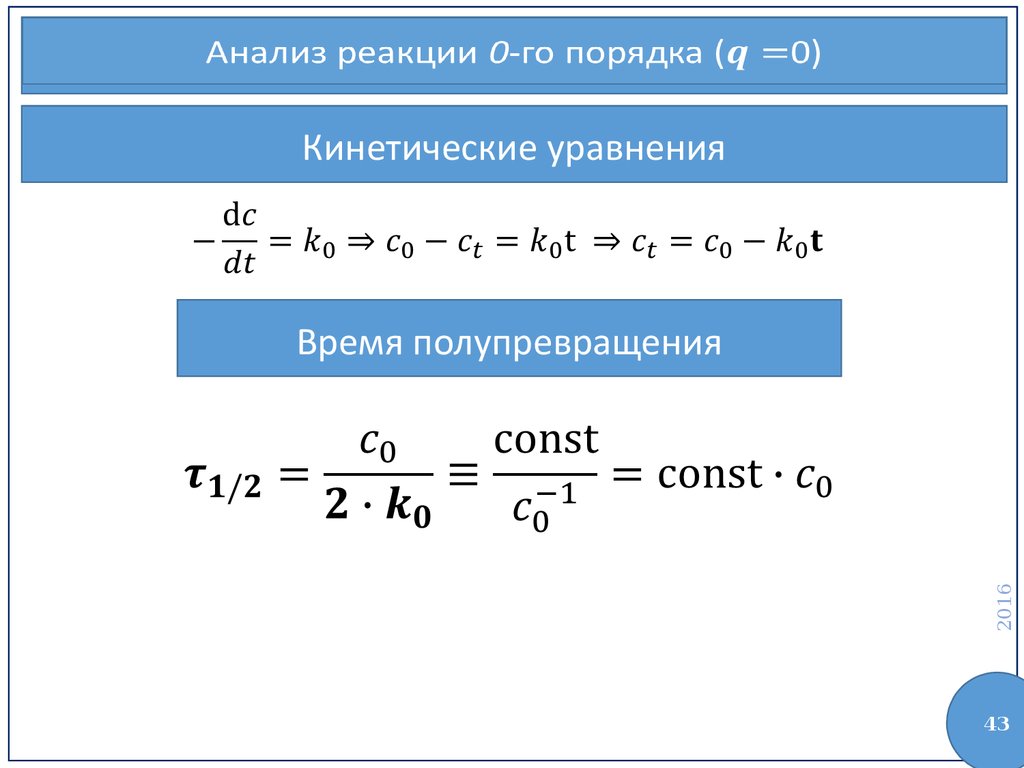
43.
Анализ реакции 0-го порядка (0)Кинетические уравнения
2016
Время полупревращения
43
44.
Анализ реакции 2-го порядка ()Кинетические уравнения
2016
Размерность
44
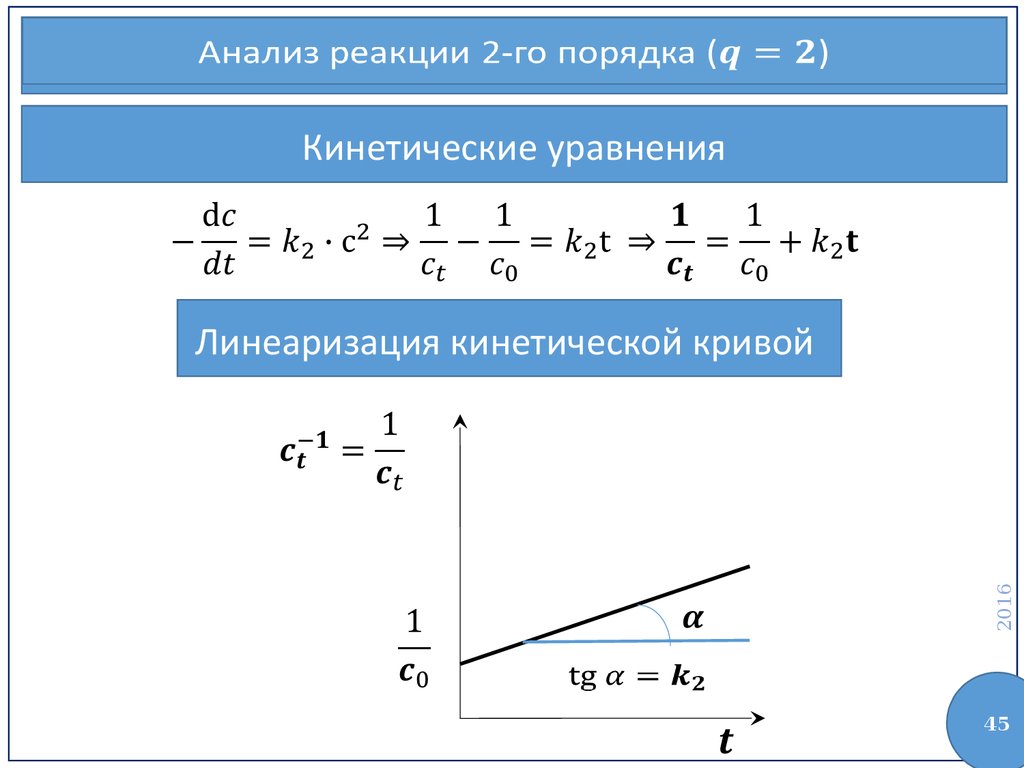
45.
Анализ реакции 2-го порядка ()Кинетические уравнения
2016
Линеаризация кинетической кривой
45
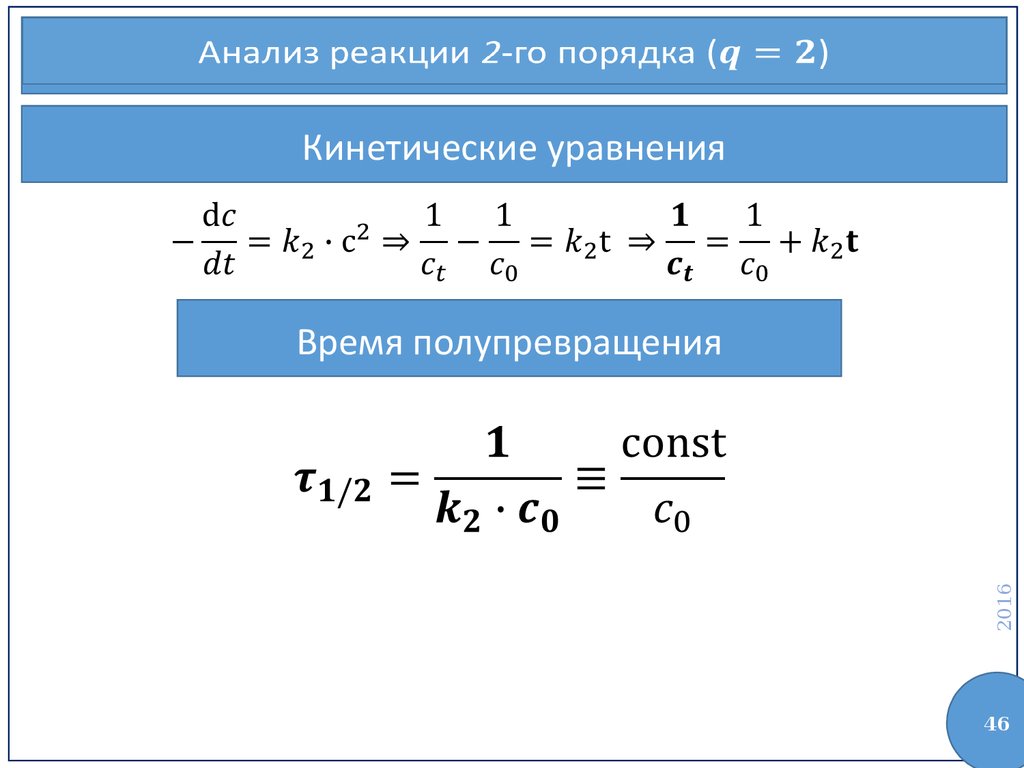
46.
Анализ реакции 2-го порядка ()Кинетические уравнения
2016
Время полупревращения
46
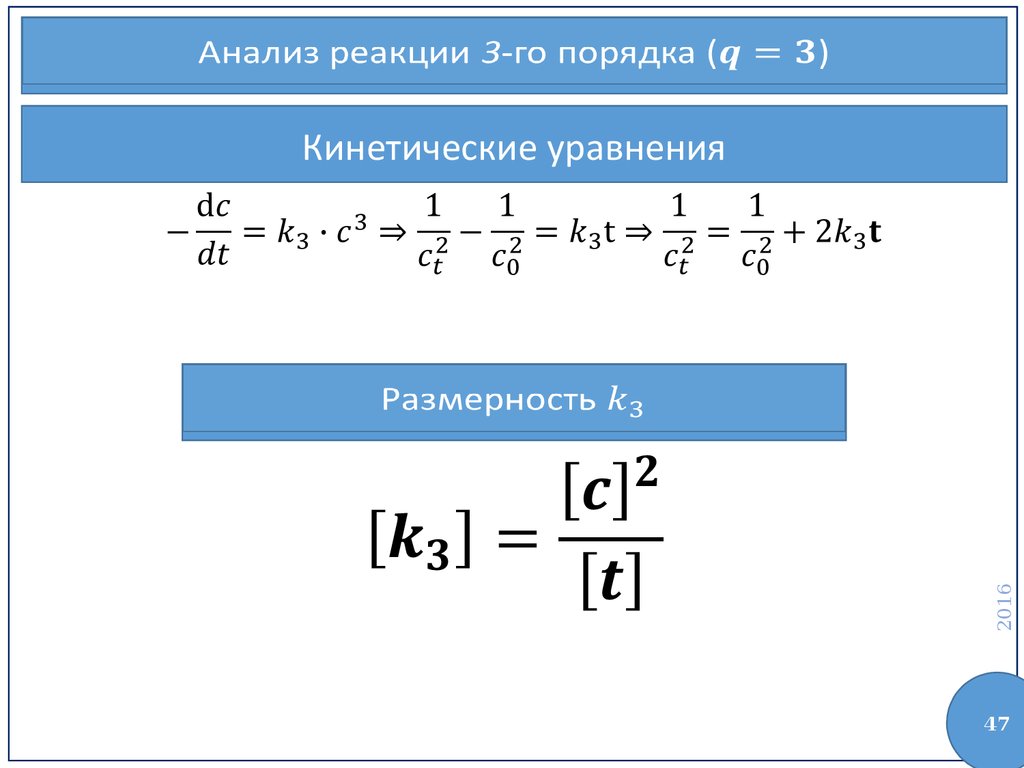
47.
Анализ реакции 3-го порядка ()Кинетические уравнения
2016
Размерность
47
48.
Анализ реакции 3-го порядка ()Кинетические уравнения
2016
Линеаризация кинетической кривой
48
49.
Анализ реакции 3-го порядка ()Кинетические уравнения
2016
Время полупревращения
49
50.
Влияние температуры на скорость реакцииПравило Вант-Гоффа
2016
Соблюдается не для всех реакций!
50
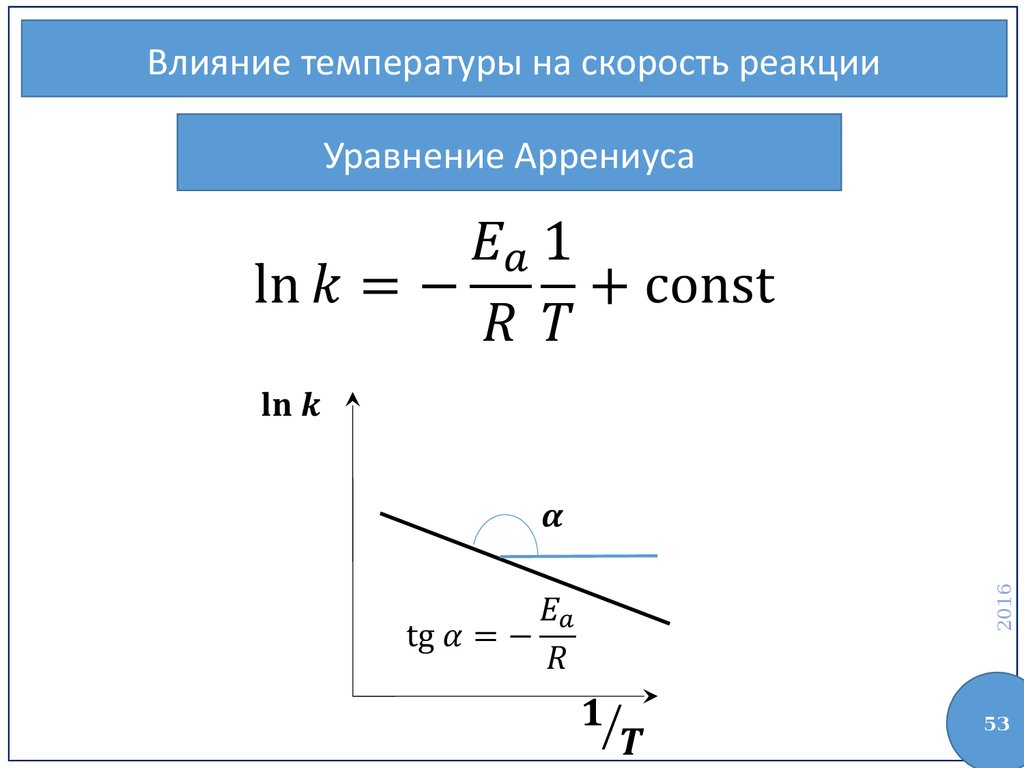
51.
Влияние температуры на скорость реакцииУравнение Аррениуса
2016
—
энергия активации
51
52.
Влияние температуры на скорость реакции2016
Уравнение Аррениуса
52
53.
Влияние температуры на скорость реакции2016
Уравнение Аррениуса
53
54.
Влияние температуры на скорость реакции2016
Уравнение Аррениуса
54




































 Физика
Физика Химия
Химия








