Похожие презентации:
Химическая связь
1. Химическая связь
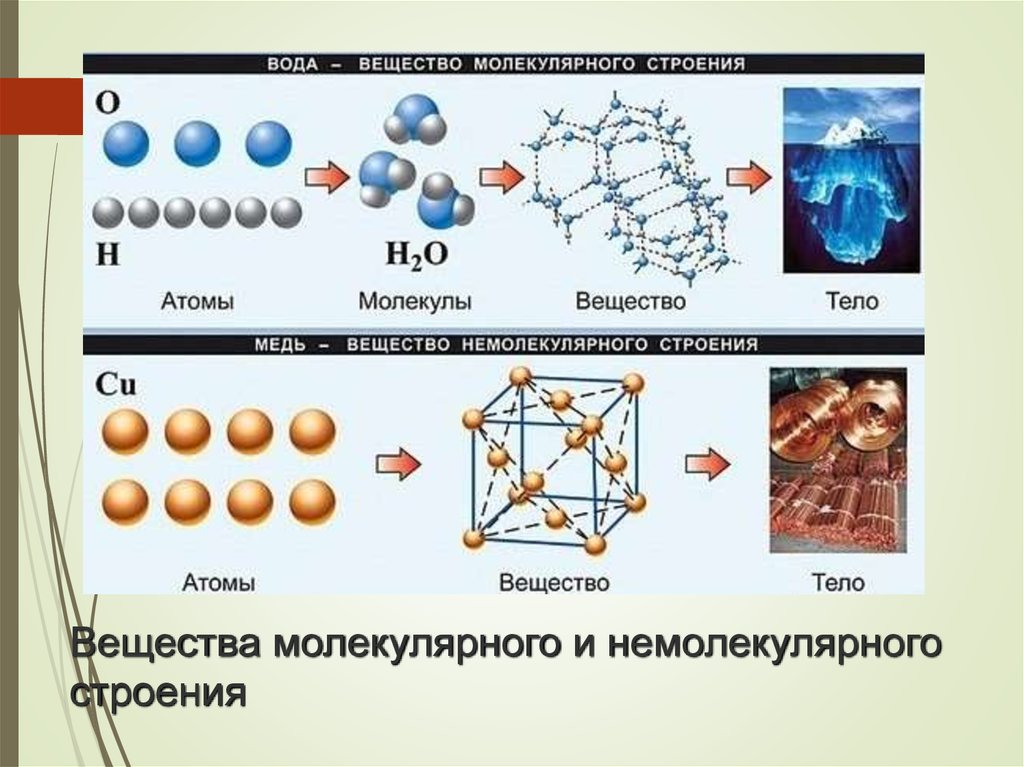
2. Вещества молекулярного и немолекулярного строения
3. Типы химической связи
Ковалентная• неполярная
• полярная
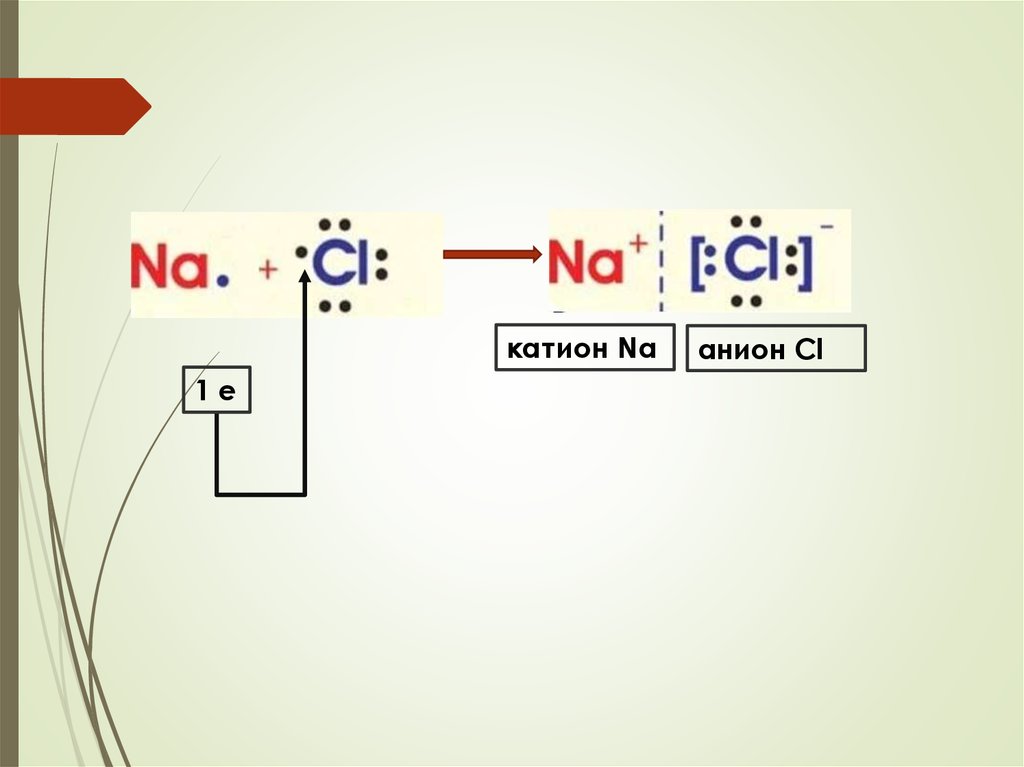
Ионная
Металлическая
Межмолекулярная
• водородная
• ван-дер-ваальсова
4. Химическая связь
1) имеет электромагнитнуюприроду
2) в результате образования
связи происходит понижение
энергии системы
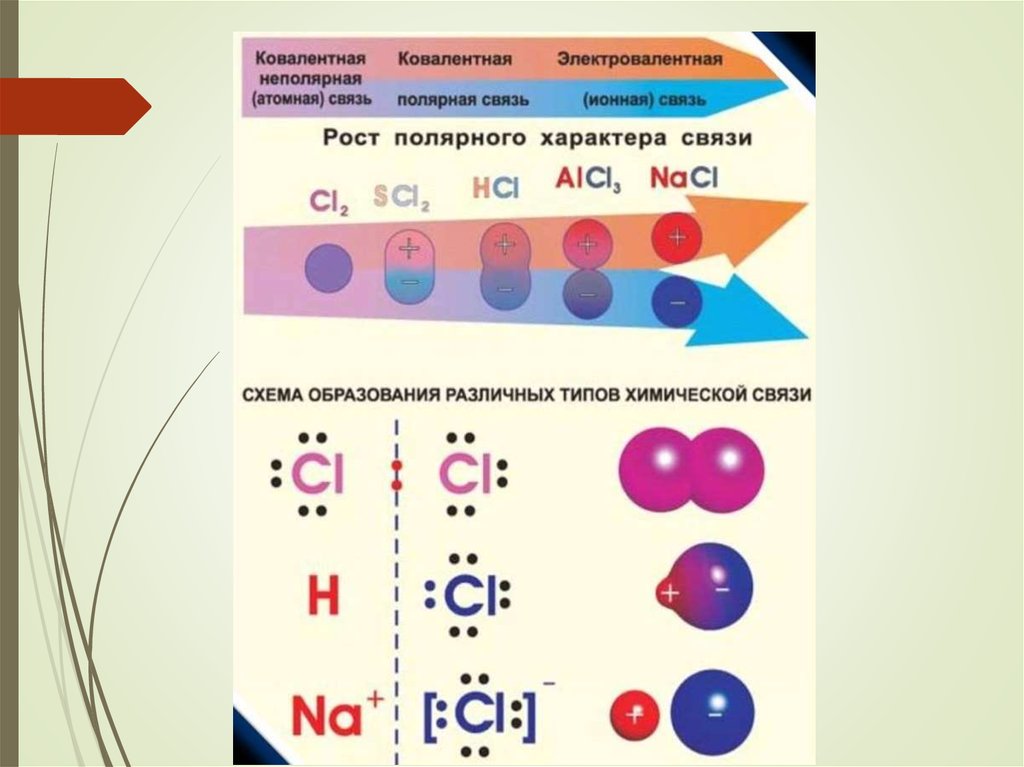
5. 1. Ковалентная связь
Наиболее прочный тип химической связиЕсв до 800 кДж/моль
6.
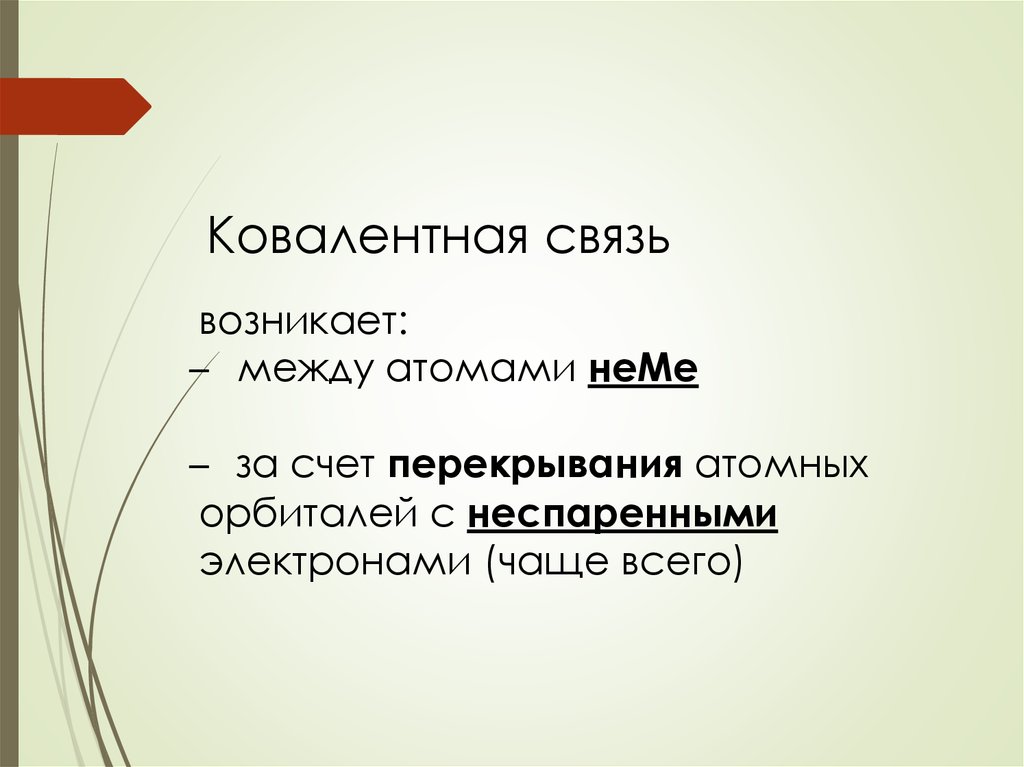
Ковалентная связьвозникает:
̶ между атомами неМе
̶ за счет перекрывания атомных
орбиталей с неспаренными
электронами (чаще всего)
7. Ковалентная связь при этом образуются: ̶ общая для двух атомов электронная пара, ̶ молекулярная орбиталь.
8. Электроотрицательность (ЭО)
количественно описываетнеметаллические свойства атома
оценивает способность атома ХЭ
притягивать к себе общую
электронную пару при образовании
ковалентной связи
значение ЭО можно рассчитать
9. Электроотрицательность (ЭО)
это способность атомов,принимающих участие в образовании
ковалентной связи, притягивать к себе
общую электронную пару
чем больше разница в значениях ЭО
связанных атомов, тем больше
полярность ковалентной связи
10. 1а. Ковалентная неполярная связь
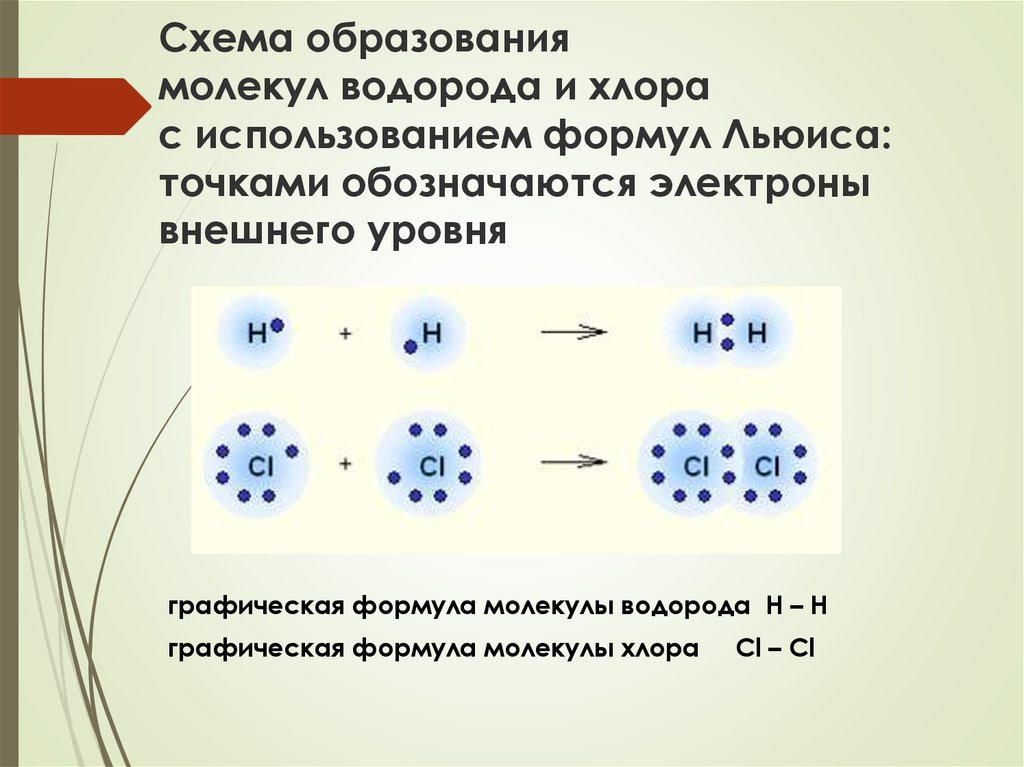
11. Схема образования молекул водорода и хлора с использованием формул Льюиса: точками обозначаются электроны внешнего уровня
графическая формула молекулы водорода Н – Нграфическая формула молекулы хлора
Cl – Cl
12. Ковалентная неполярная связь
образуется между одинаковыми атомами неМеобщая е-пара:
расположена симметрично относительно
центров атомов
в равной мере принадлежит обоим атомам, т.к.
их ЭО одинакова (примеры: H2, O2, О3)
















 Химия
Химия








