Похожие презентации:
Циклические эфиры (окиси)
1. Циклические эфиры (Окиси)
126.11.2018
2.
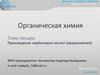
I Классификация1.В зависимости от колличества атомов в цикле:
α – циклы
CH2 – CH2
CH2 – CH – CH3 CH3 – СH – CH – CH3
О
β – циклы
CH2 – CH2 – CH2
O
O
CH2 – CH2 – CH – CH3
О
O
γ – циклы
CH2 – CH2
CH2
CH2
2
О
26.11.2018
3.
II Номенклатура и изомерия1. Тривиальная (эмпирическая):
CH2 – CH2
CH2 – CH – CH3
О
окись этилена
O
окись пропилена
3
26.11.2018
4.
2. Систематическая (IUPAC):1
CH2 – CH2
2
3
CH2 – CH – CH3
О
эпоксиэтан
1
2
3
O
1,2 эпоксипропан
4
1
CH3 – СH – CH – CH3
О
2,3 эпоксибутан
2
3
CH2 – CH2 – CH2
О
1,3 эпоксипропан
4
26.11.2018
5.
12
3
4
CH2 – CH2 – CH – CH3
О
1,3 эпоксибутан
2
3
CH2 – CH2
1
CH2
4
CH2
О
1,4 эпоксибутан
5
26.11.2018
6.
III Способы получения1.Прямое каталитическое окисление этилена
О2
2 CH2 = CH2
2 CH2 – CH2
Ag
О
2.Дегидрохлорирование этилена
CH2 = CH2 + Cl2 + Н2О
Cl
NaOH
-NaCl
CH2 – CH2
CH2 – CH2
ОН
хлоргидрин этилена
-Н2О
О
6
26.11.2018
7.
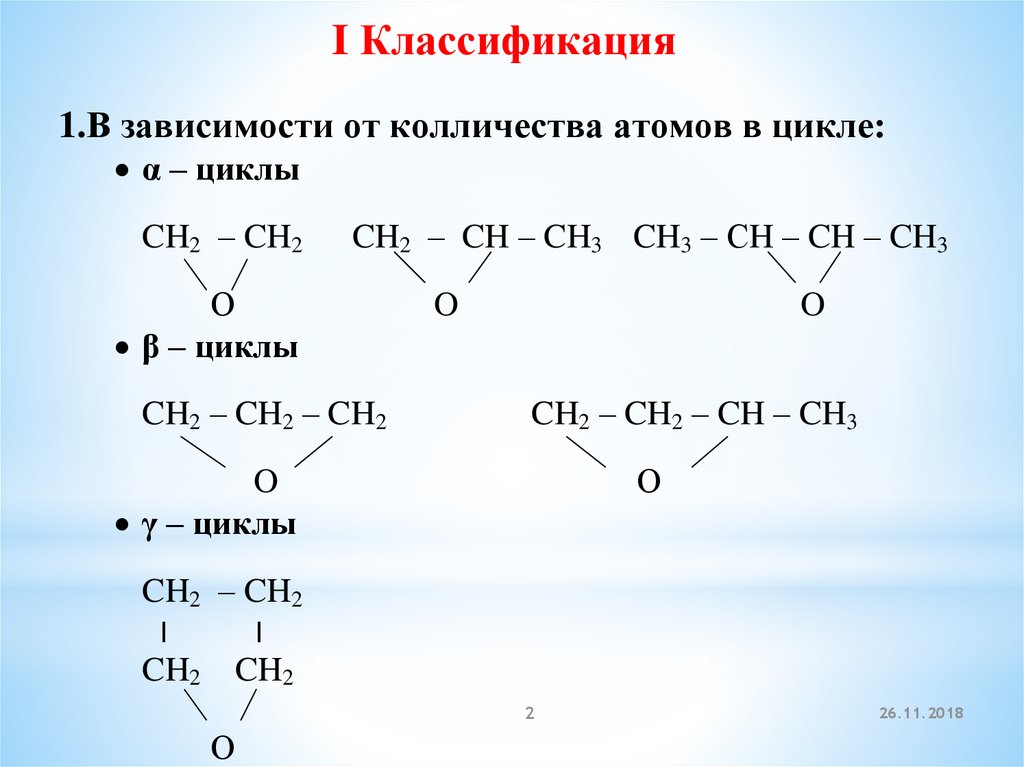
3.Взаимодействие этилена с надбензойнойкислотой:
CH2 = CH2
О
||
+ С – О – ОН
CH2 – CH2
надбензойная кислота
+
О
||
С – ОН
бензойная кислота
7
26.11.2018
8.
826.11.2018
9.
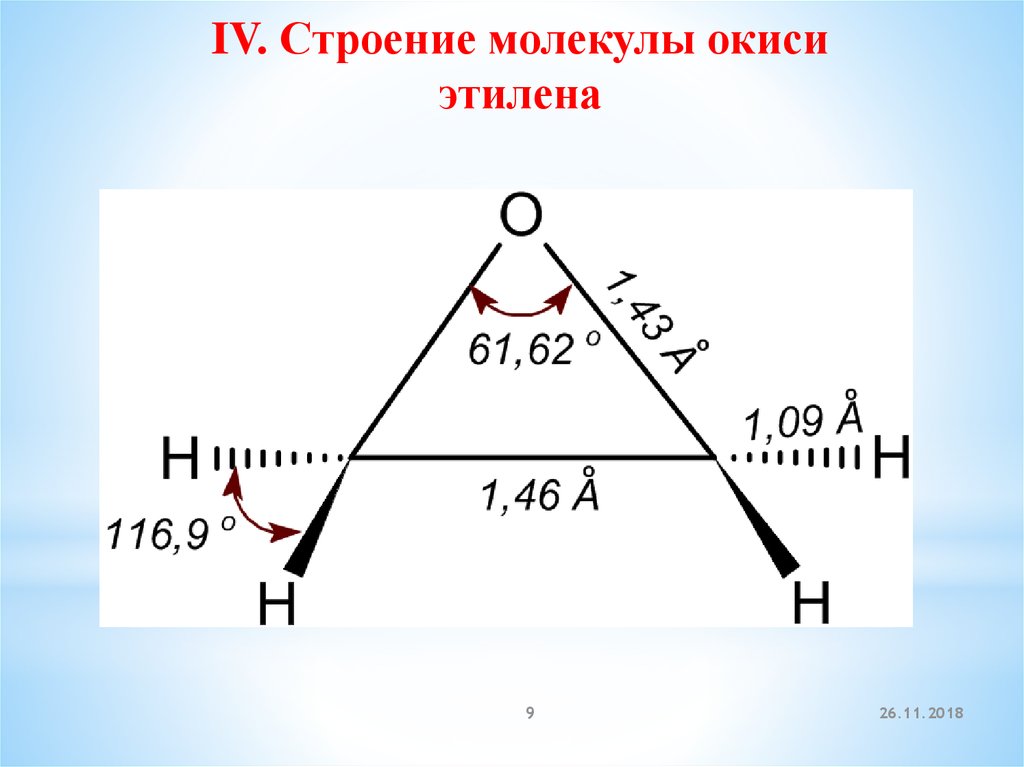
IV. Строение молекулы окисиэтилена
9
26.11.2018
10.
Благодаря особенностям молекулярной структуры, окисьэтилена вступает в реакции присоединения с раскрытием
цикла, и таким образом легко подвергается
полимеризации.
Вещество является чрезвычайно огне- и взрывоопасным.
Окись этилена обладает дезинфицирующими свойствами,
а также является сильным ядом для человека, проявляя
канцерогенное, мутагенное, раздражающее и
наркотическое действие.
Окись этилена является одним из важных объектов
основного органического синтеза и широко используется
для получения многих химических веществ и
полупродуктов, в частности этиленгликолей,
этаноламинов, простых и сложных гликолевых и
полигликолевых эфиров и прочих соединений.
10
26.11.2018
11.
IV Химические свойства1.Реакции, катализируемые кислотами:
+
CH2 – CH2
О
+
H+
CH2 – CH2
О+
+Z-
CH2 – CH2
CH2 – CH2
ОН
ОН
Z
Н
11
26.11.2018
12.
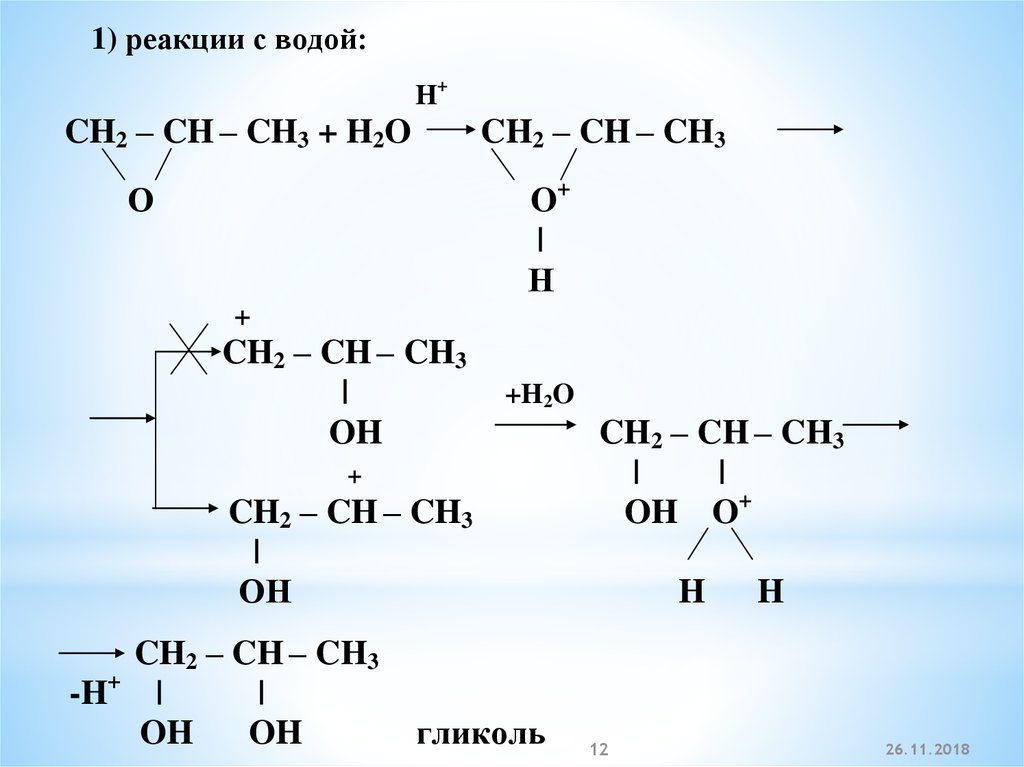
1) реакции с водой:H+
CH2 – CH – CH3 + H2O
CH2 – CH – CH3
O+
|
Н
О
+
CH2 – CH – CH3
|
OH
+H2O
+
CH2 – CH – CH3
|
ОН
CH2 – CH – CH3
-H+ |
|
OH
OH
гликоль
CH2 – CH – CH3
|
|
OH O+
H
12
H
26.11.2018
13.
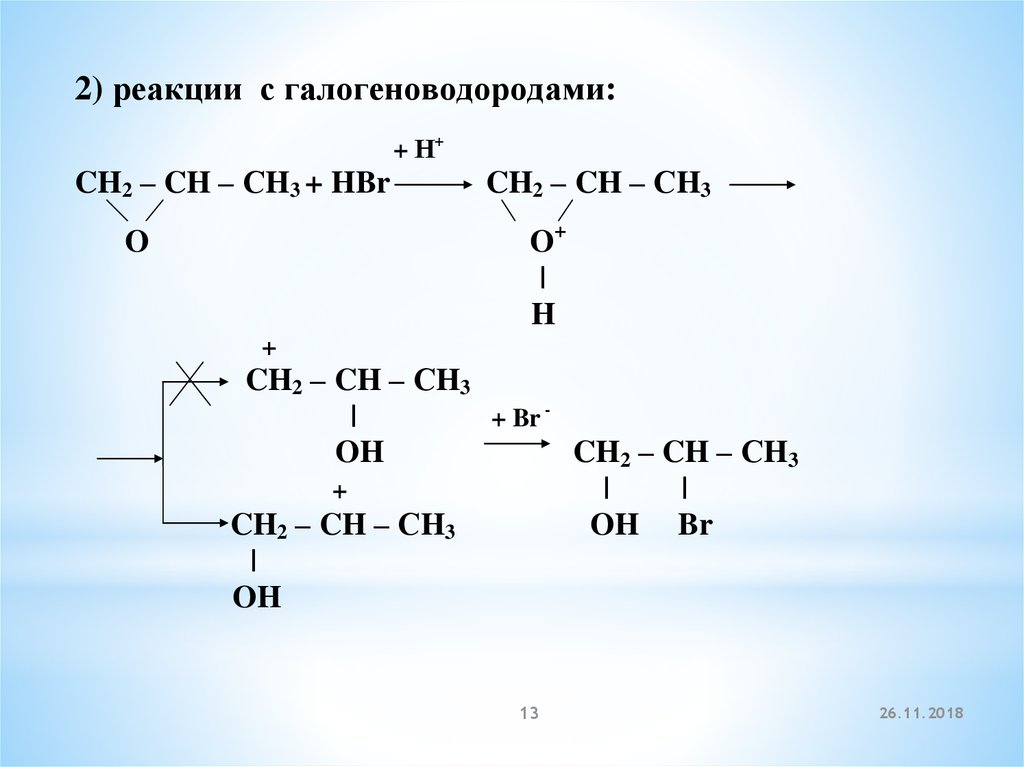
2) реакции с галогеноводородами:+ Н+
CH2 – CH – СH3 + HBr
CH2 – CH – СH3
O+
|
H
O
+
CH2 – CH – СH3
|
+ Br OH
CH2 – CH – СH3
+
|
|
CH2 – CH – СH3
OH Br
|
OH
13
26.11.2018
14.
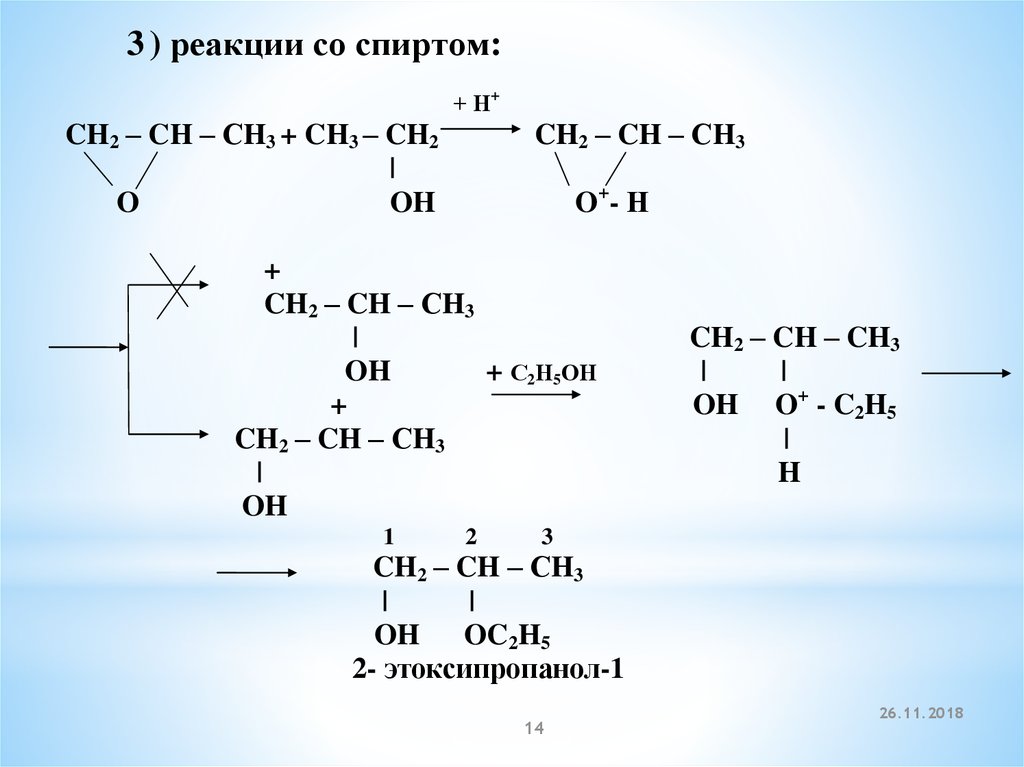
3 ) реакции со спиртом:+ Н+
CH2 – CH – СH3 + CH3 – CH2
|
O
OH
CH2 – CH – СH3
O+ - Н
+
CH2 – CH – СH3
|
OH
+ С2Н5ОН
+
CH2 – CH – СH3
|
OH
1
2
CH2 – CH – CH3
|
|
OH O+ - C2H5
|
H
3
CH2 – CH – СH3
|
|
OH OC2H5
2- этоксипропанол-1
14
26.11.2018
15.
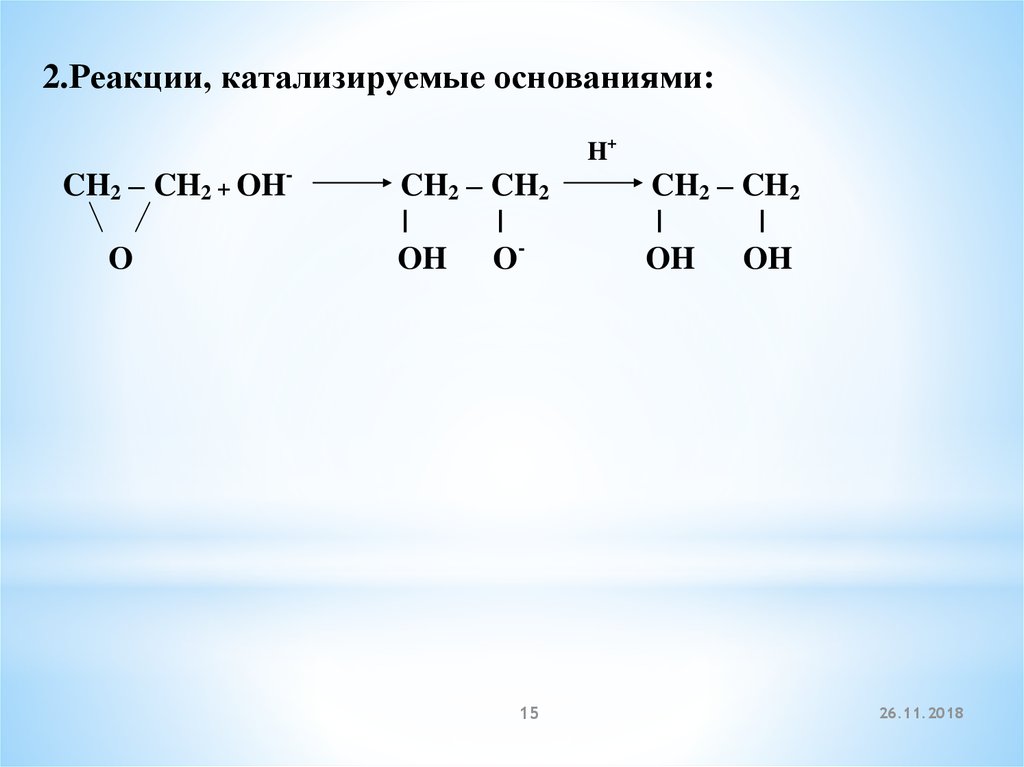
2.Реакции, катализируемые основаниями:H+
CH2 – CH2 + OHO
CH2 – CH2
|
|
OH O-
15
CH2 – CH2
|
|
OH
OH
26.11.2018
16.
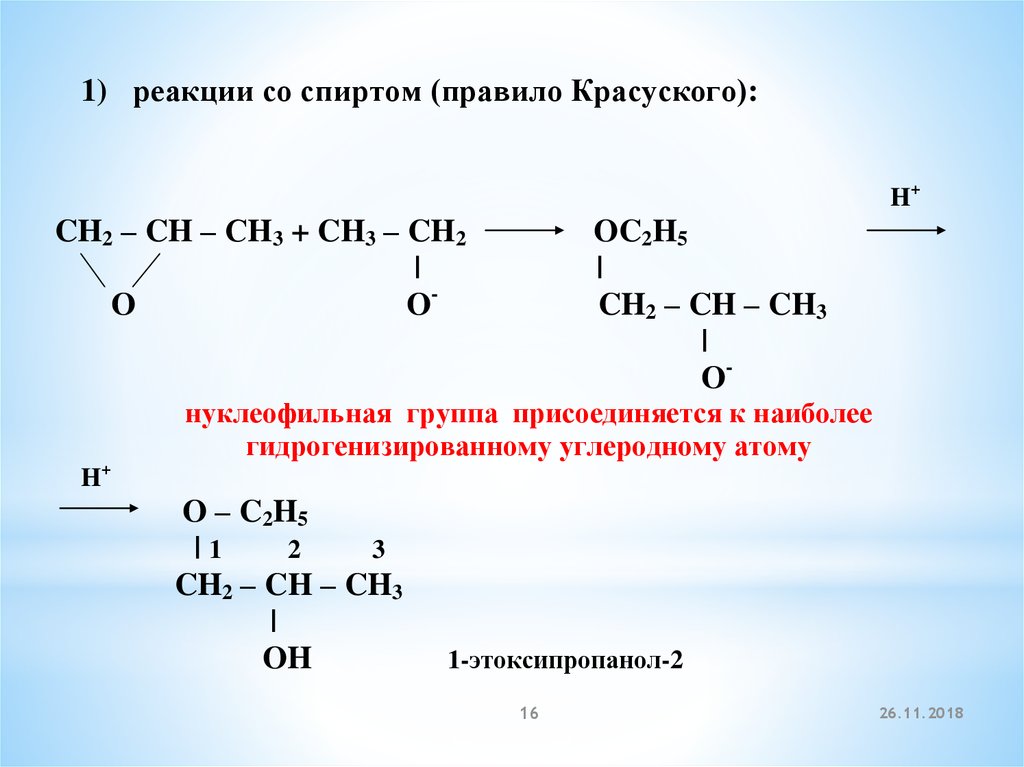
1) реакции со спиртом (правило Красуского):H+
CH2 – CH – СH3 + CH3 – CH2
|
O
O-
OC2H5
|
CH2 – CH – CH3
|
O-
нуклеофильная группа присоединяется к наиболее
гидрогенизированному углеродному атому
H+
O – C2H5
|1
2
3
CH2 – CH – CH3
|
OH
1-этоксипропанол-2
16
26.11.2018
17.
2) реакции с аммиаком и аминами:CH2 – CH – СH3 + NH3
O
CH2 – CH – CH3
|
|
NH3+ O-
CH2 – CH – CH3
|
|
NH2 OH
CH2 – CH – СH3 + CH3NH2
O
CH2 – CH – СH3
|
|
CH3 – NH OH
CH2 – CH – СH3
|
|
N+H2 O|
CH3
17
26.11.2018
18.
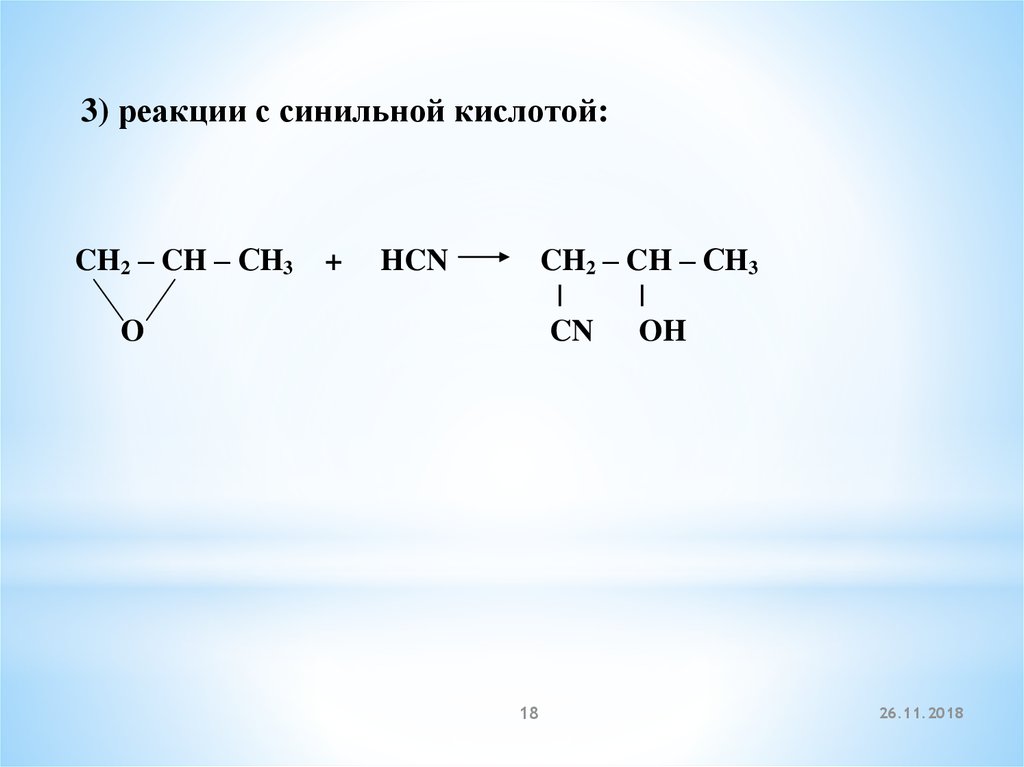
3) реакции с синильной кислотой:CH2 – CH – СH3
+
CH2 – CH – СH3
|
|
CN OH
HCN
O
18
26.11.2018
19.
4) реакции с реактивом Гриньяра:+ H2O
CH2 – CH2
+
CH3 – MgCl
CH2 – CH2
O
H2O
CH3
O - MgCl
CH2 – CH2
|
|
CH3 OH
19
26.11.2018
20. Спасибо за Ваше внимание!
2026.11.2018










 Химия
Химия