Похожие презентации:
Количество теплоты. Теплоёмкость
1.
Количество теплоты. Теплоёмкость.Количество теплоты Q - это величина
энергии теплового движения молекул,
переданной от одного тела к другому.
2.
Способы теплопередачи3.
Теплоемкость тела - это количество теплоты,необходимое для нагревания тела на 1 К.
С
Q
dT
Дж
К
Молярная теплоемкость – это количество
теплоты, необходимое для нагревания
одного моля вещества на 1 К.
Q
CM
dT
Дж
моль К
4.
Удельная теплоемкость - это количествотеплоты, необходимое для нагревания
единицы массы вещества (1 кг) на 1 К.
c
Q
mdT
Дж
кг К
Связь молярной и удельной
теплоемкостей
CМ М c
5.
Первое начало термодинамикиQ dU A
Количество теплоты, сообщенное системе,
идет на увеличение внутренней энергии
системы и на совершение системой
работы над внешними телами.
Отражает закон сохранения энергии
для термодинамических систем.
В интегральной форме:
Q U A
6.
Расчет молярных теплоемкостей визопроцессах
1. Изотермический процесс.
Так как T const ., то внутренняя энергия
газа не изменяется:
dU 0 и
Q A
Так как
dT 0 , то
CT
Q
dT
I НТД
7.
2. Изохорный процесс.В изохорном процессе dA 0.
Q dU
CV
Q 1 dU
dT dT
i
dU RdT
2
i
CV R
2
8.
3. Изобарный процессQ dU pdV
Cp
Q
dU
pdV
dT dT dT
CV
работа моля газа при
нагревании на 1 К
8
9.
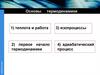
Из уравнения М-К: pdV RdTpdV RdT
R
dT
dT
C p CV R
Уравнение Майера
C p CV
10.
Отношение теплоемкостей :CV
Cp
i
i 2
R R
R
2
2
i
R
2
Cp
CV
i 2
i
- коэффициент Пуассона
11.
Адиабатический процессАдиабатический процесс происходит без
теплообмена с внешней средой.
Q 0
dU A =0
A = dU
Газ совершает работу за счет своей внутренней
энергии. При адиабатическом расширении он
охлаждается, при сжатии – нагревается.
12.
Уравнение Пуассона для адиабатного процессаPV const .
или
T V
1
const .
13.
Семейства изотерм (красные кривые) иадиабат (синие кривые) .
14.
Работа в адиабатическом процессеi
dA dU RdT
2
T2
i
i
A R dT R T1 T2
2 T1
2
i 2
2
1 ,
i
i
i
1
2 1
R
A
T1 T2
1
15.
Макро- и микросостоянияМакросостояние – это состояние, заданное
с помощью величин, характеризующих
всю систему в целом (p, V, T).
Микросостояние – это состояние, заданное
с помощью координат и импульсов всех
молекул.
Одному макросостоянию может
соответствовать множество
микросостояний.
16.
Одно и то же макросостояние2 =2
1
2
1
Разные макросостояния
1
1
2
2
=1
=1
17.
Число микросостояний , соответствующих данному макросостоянию,называют термодинамической
вероятностью или статистическим
весом этого макросостояния.
18.
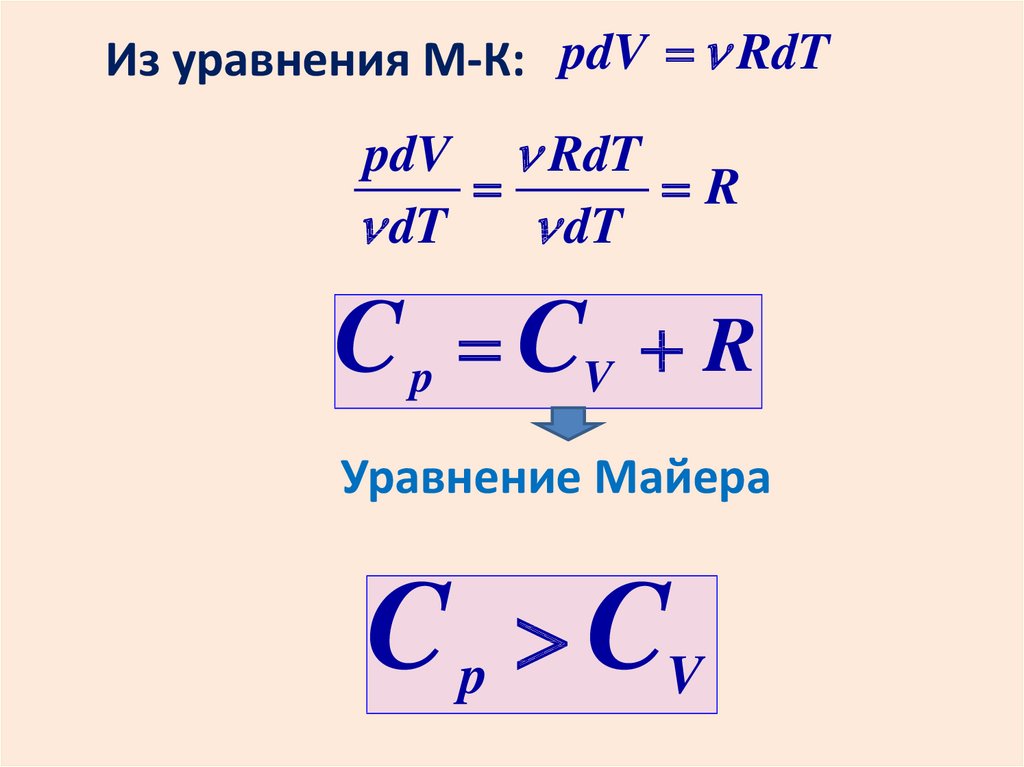
Равновесному макросостоянию соответствует наибольшая термодинамическаявероятность: max .
Это состояние
неравновесное
min
19.
Система может испытывать небольшиеотклонения от равновесного состояния.
Их называют флуктуациями.
N – число молекул справа (слева)
N
2
t
20.
Обратимый процесс может происходить какв прямом, так и в обратном направлении
через те же промежуточные состояния. Если
система вернулась в исходное состояние, ни
в ней, ни в окружающей среде не возникает
никаких изменений. Обратимый процесс
протекает через равновероятные состояния.
21.
К обратимым процессам относятсяпроцессы, представляющие собой
непрерывную последовательность
равновесных состояний, например,
очень медленно протекающие
процессы.
22.
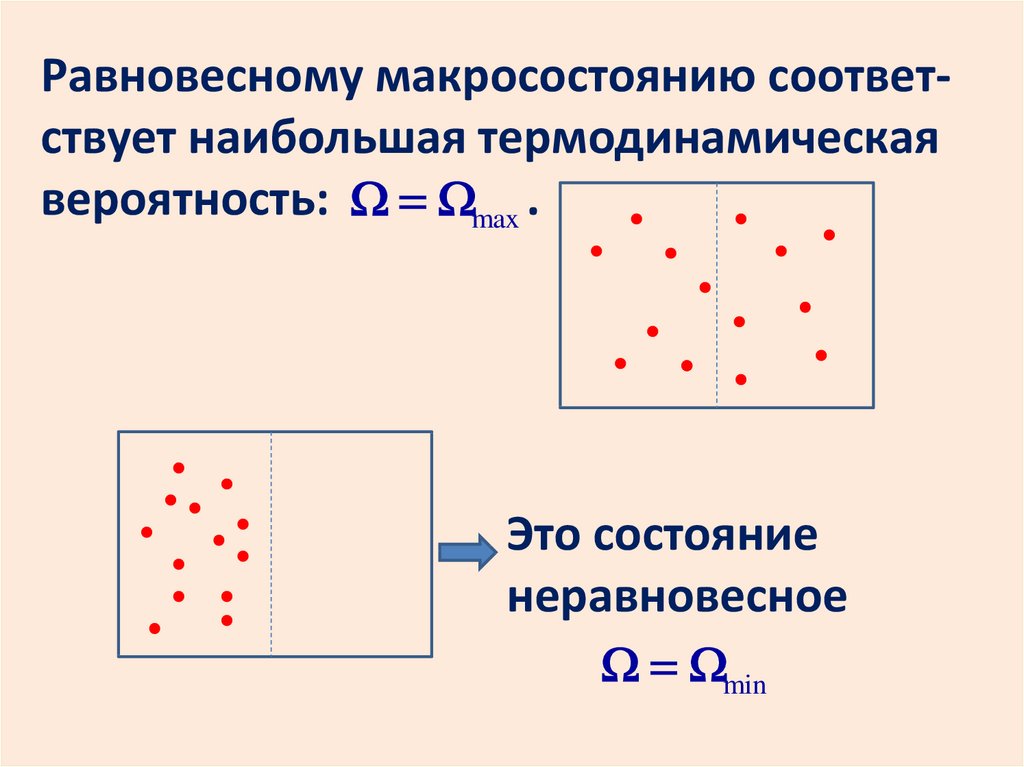
Необратимые процессы протекаюттолько в одном направлении. Обратные
им процессы маловероятны. Например,
расширение газа в пустоту.
23.
ЭнтропияВеличину S
энтропией.
k ln
называют
Энтропия характеризует степень
молекулярного беспорядка.
Упорядоченные состояния реализуются
малым числом способов – энтропия мала.
Неупорядоченные состояния реализуются
большим числом способов – энтропия
велика.
24.
Второе начало термодинамикиВ изолированной системе энтропия не
убывает.
dS 0
Она увеличивается при необратимом
процессе и остается неизменной при
обратимом процессе.
25.
Вычисление энтропииQ
T
Отношение
называют
приведенной теплотой.
В обратимом процессе
dS
Q
T2
S
T1
T
Q
T
26.
Для адиабатического процесса Q=0 .
S = const.
Это изоэнтропный процесс.
27.
QdU A
dS
T
T
dT pdV
dS CV
T
T
RT
Выразим давление из ур-я М-К: p
V
dT
dV
S CV
R
T
V
T2
V2
S2 S1 CV ln R ln
T1
V1
28.
Третье начало термодинамики(теорема Нернста )
lim S 0
T 0
Следствия:
1. Любая теплоемкость системы при
T 0 стремится к нулю.
2. Абсолютный нуль температуры
недостижим.
29.
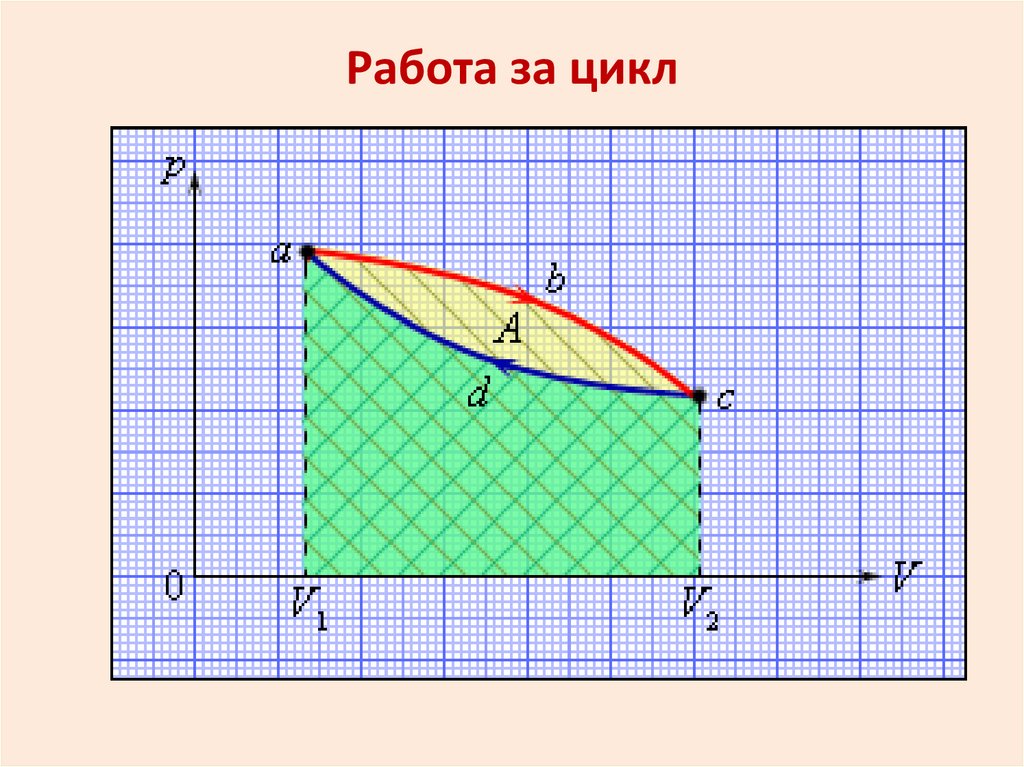
Круговые процессы (циклы)Круговым процессом или циклом
называется такой процесс, по
завершении которого система
возвращается в исходное
состояние.
В круговом процессе внутренняя
энергия не изменяется.
30.
Работа за цикл31.
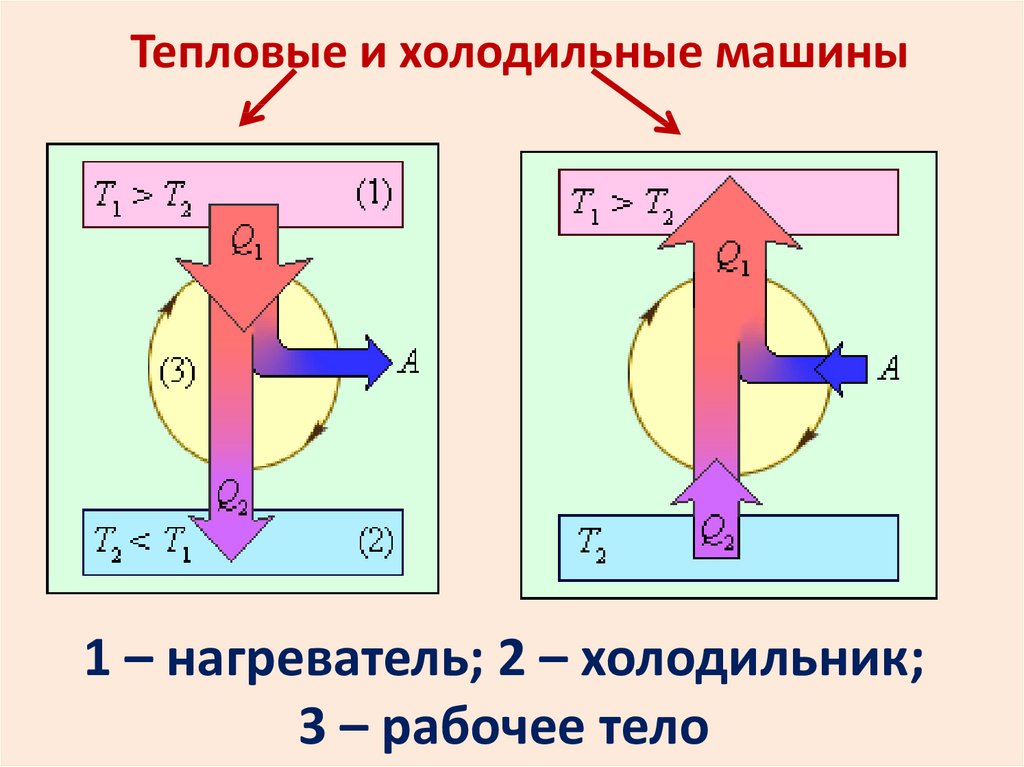
Тепловые и холодильные машины1 – нагреватель; 2 – холодильник;
3 – рабочее тело
32.
КПД тепловой машиныпрямой цикл
Q1 U 2 U1 A1
Q2 U1 U 2 A2
Q1 Q2 A1 A2 A
Q2
A Q1 Q2
1
Q1
Q1
Q1
33.
КПД холодильной машиныобратный цикл
Q2
Q2
*
A Q1 Q2
34.
Цикл КарноQ1 Q2
S
0
T1 T2
Q2 Q1
T2 T1
Q2 T2
Q1 T1
Q2
T2 T1 T2
1
1
Q1
T1
T1





























 Физика
Физика