Похожие презентации:
Металлы. Обобщающий урок
1.
ОБОБЩАЮЩИЙ УРОКПО ТЕМЕ «МЕТАЛЛЫ»
2.
ЭПИГРАФ• «Металлов много есть,
но дело не в количестве
В команде работящей металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов.»
3.
Ответьте на предложенные вопросы.1. Самый распространённый металл в земной
коре
2. От соединений какого металла зависит
красный цвет крови?
3. Самый легкий и самый тяжелый металлы?
4. Свойство атома химического элемента
образовывать несколько простых веществ
5. Металл, входящий в состав нержавеющих и
жаропрочных сталей
6. Какие металлы можно зажечь холодной водой?
4.
• 7. Металл, входящий в состав рубина, граната,сапфира, бирюзы
• 8. Название металла происходит от латинского
слова, которое в переводе означает "известь"
• 9. Из чего отлит памятник «Медный всадник»?
• 10. Ядро атома металла содержит 80 протонов
• 11. От соединений какого металла зависит зелёная
окраска растений?
• 12. Атом какого металла содержит 30 электронов?
• 13. Самый тугоплавкий металл
• 14. Сплав этого металла называют крылатым»?
• 15. Методы переработки руд при высоких
температурах?
5.
N, HG, O, H, W, S, LI, СR, F, AGHg, W, Сr,
– самый
Li,
легкий металл;
Ag
Li
– самый тугоплавкий металл;
W
– жидкий металл;
Hg
– самый электропроводный металл;
Ag
– самый твердый металл.
Сr
6.
7.
8.
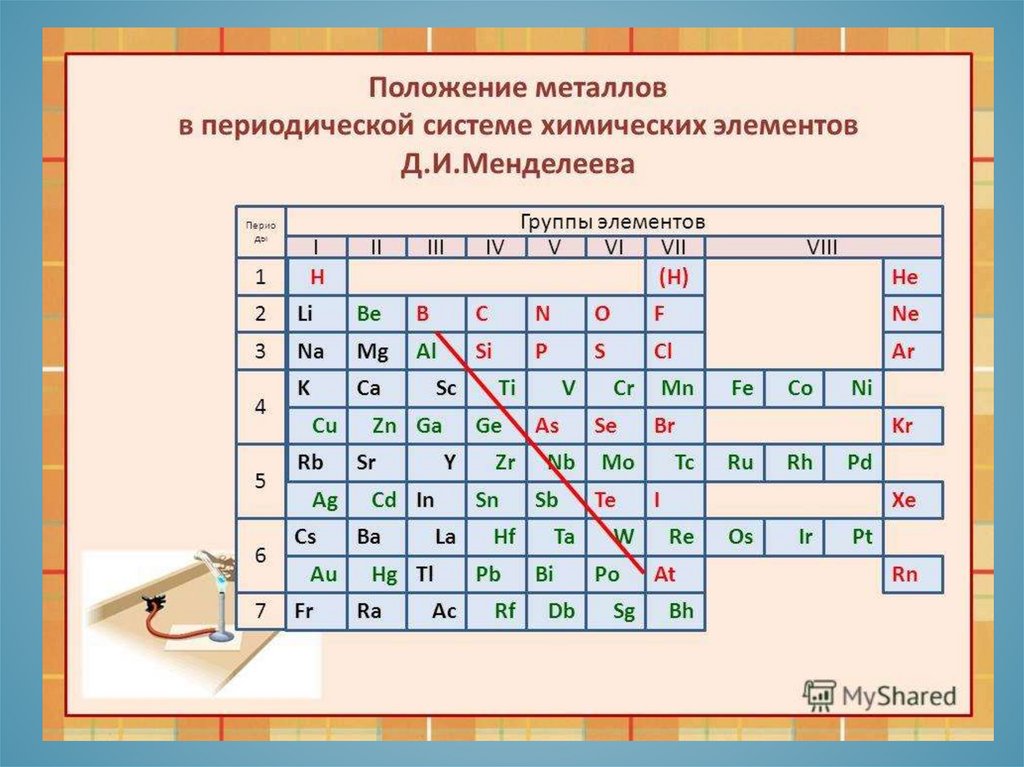
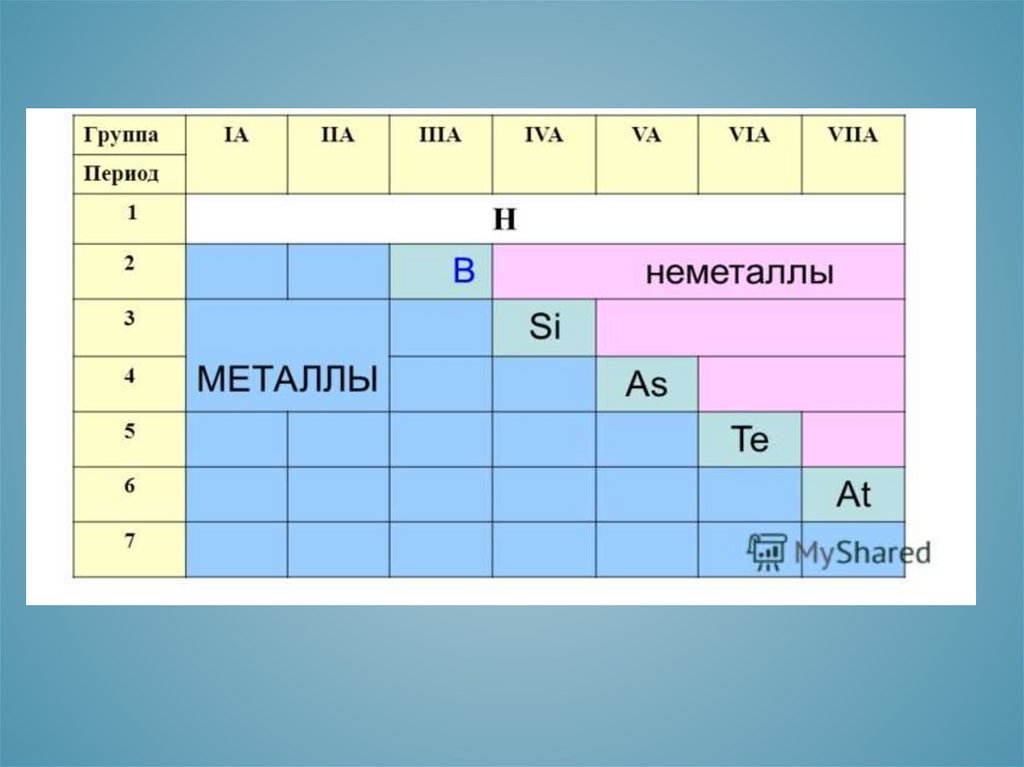
ОСОБЕННОСТИ СТРОЕНИЯ АТОМОВМЕТАЛЛОВ
1. Небольшое число электронов
на последнем энергетическом
уровне( от 1 до 3)
2. Относительно большой
атомный радиус.
9.
10.
ОБЩИЕ СВОЙСТВАМЕТАЛЛОВ
Ме
Химические элементы
Ме0 – ne → Me+n
n = 1,2,3…
Из 110 химич.элементов -85 Ме
Металлическая связь
Простые вещества
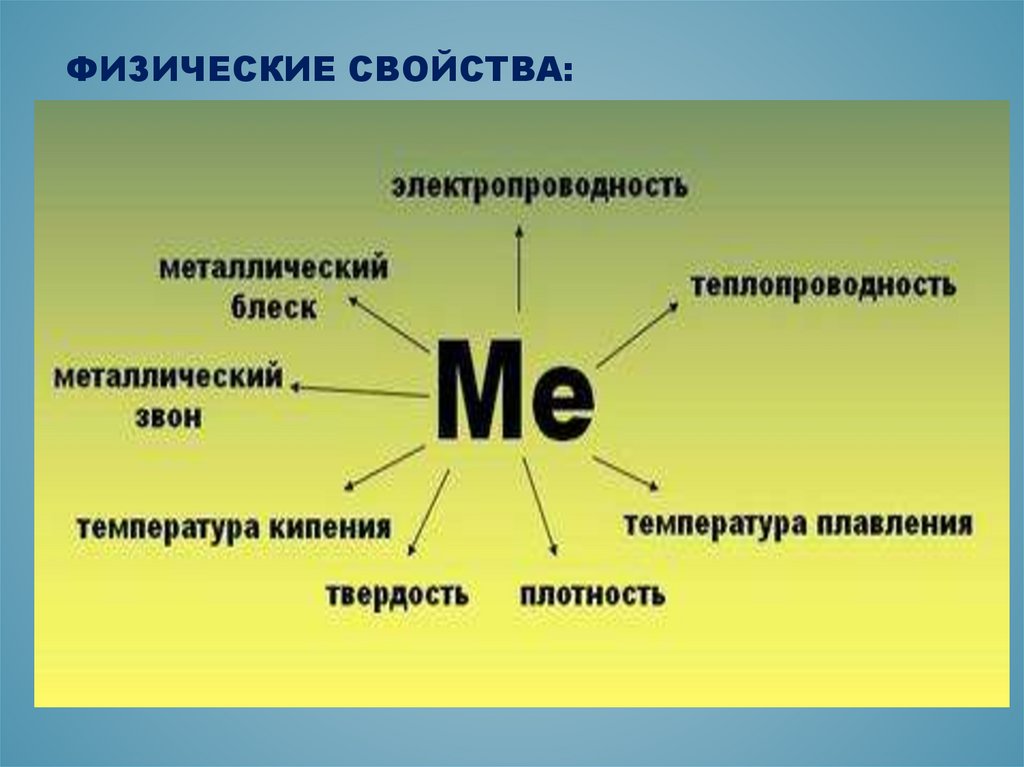
Физические свойства
(общие)
- Ковкость(пластичность)
- Твердость
- Металлический блеск
- Электропроводность
(Ag,Cu, Al)
- Теплопроводность (Ag,Cu,
Al, Fe)
11.
ФИЗИЧЕСКИЕ СВОЙСТВА:12.
В ряду левее водородаСреди металлов нет урода:
Все растворимы в кислоте,
А те, что с краю, и в воде.
Зато на правом фланге “знать”
Кислот в упор не хочет знать…
13.
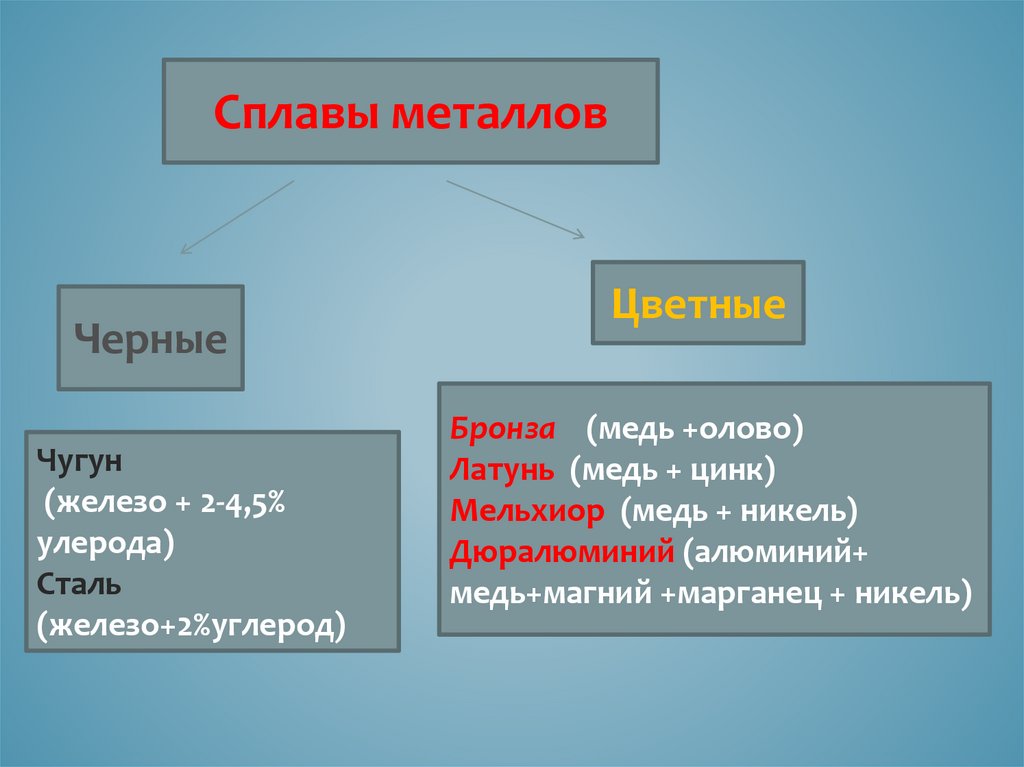
Сплавы металловЧерные
Чугун
(железо + 2-4,5%
улерода)
Сталь
(железо+2%углерод)
Цветные
Бронза (медь +олово)
Латунь (медь + цинк)
Мельхиор (медь + никель)
Дюралюминий (алюминий+
медь+магний +марганец + никель)
14.
15.
16.
17.
ДОПИШИТЕ УРАВНЕНИЯВОЗМОЖНЫХ РЕАКЦИЙ
Zn + H2O =
Fe +2HCl = FeCl2 + H2
3Zn +2H3PO4 = Zn3(PO4)2 + 3H2
Cu + H2O =
2 Al +6HCl = 2 AlCl3 + 3 H2
Pb + H2SO4(разб.) = PbSO4+ Н2
Ag + HCl =
18.
1вариант2вариант
K + O2 =
Ba + O2 =
Ba + H2O =
K + H2O =
K + Cl2 =
Ca + Cl2 =
Mg + S =
K+S=
CaO + HCl=
MgO + HCl =
Al + FeCl2=
Ca+ ZnCl2 =
19.
1 вариант2 вариант
Получить медь
Получить водород
Вещества: р-р сульфата
меди(CuSO4), гидроксид
натрия (р-р)(NaOH),
железный гвоздь (Fe), р-р
серной кислоты(H2SO4),
медная проволока (Cu)
3 CuSO4 + 2 Fe → 3 Cu + Fe2 (SO4)3
Вещества: медная
проволока (Cu), цинк(Zn),
р-р соляной кислоты
(HCl), р-р сульфата меди
(CuSO4), р-р хлорида
железа (FeCl3)
Zn+ 2 HCI → ZnCI2 + H2↑
20.
Домашнее задание:Подготовка к контрольной работе
Параграфы 7-17.
21.
СПАСИБО ЗАВНИМАНИЕ!

















 Химия
Химия








