Похожие презентации:
Реакционная способность органических соединений
1.
РЕАКЦИОННАЯ СПОСОБНОСТЬОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Механизмы передачи электронной плотности.
Статический и динамический факторы реакций.
Стереохимия органических соединений
2.
ИНДУКТИВНЫЙ ЭФФЕКТ +I, -Iзнаки эффектов заместителя совпадают
с зарядом заместителя
1. Индуктивный эффект быстро затухает
(на четвертый атом почти не влияет)
+ +
C
C
+
C
-
Cl
CH3CH2CH2COOH
CH2CH2CHClCOOH
1
α-Cl
в 70 раз сильнее
CH3CHClCH2COOH
β-Cl
в 6 раз сильнее
CH2ClCH2CH2COOH γ-Cl
в 2 раза сильнее
3.
ИНДУКТИВНЫЙ ЭФФЕКТ +I, -I2. Влияние нескольких заместителей суммируется
(но не аддитивно)
3. Чем больше ЭО, тем сильнее –Iэф:
–CR3 < –NR2 < –OR, –F
–Iэф растет
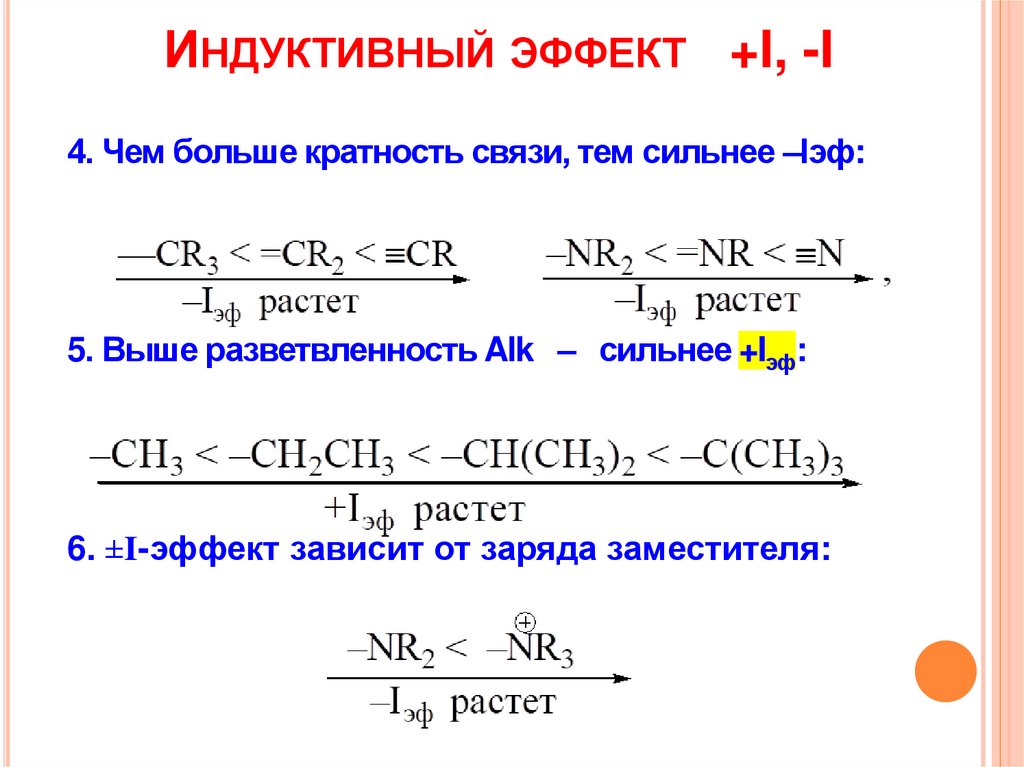
4.
ИНДУКТИВНЫЙ ЭФФЕКТ +I, -I4. Чем больше кратность связи, тем сильнее –Iэф:
5. Выше разветвленность Alk – сильнее +Iэф:
6. ±I-эффект зависит от заряда заместителя:
5.
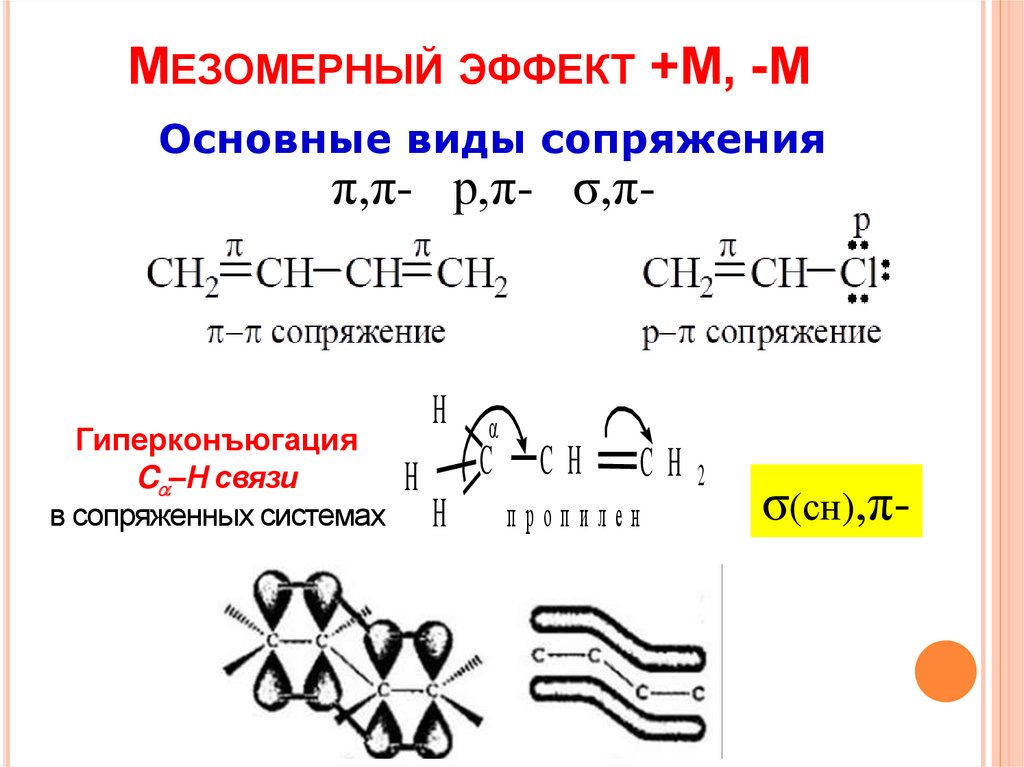
МЕЗОМЕРНЫЙ ЭФФЕКТ +М, -МОсновные виды сопряжения
π,π- р,π- σ,π-
Гиперконъюгация
C –H связи
в сопряженных системах
H
H
C
H
CH
пропилен
CH
2
σ(сн),π-
6.
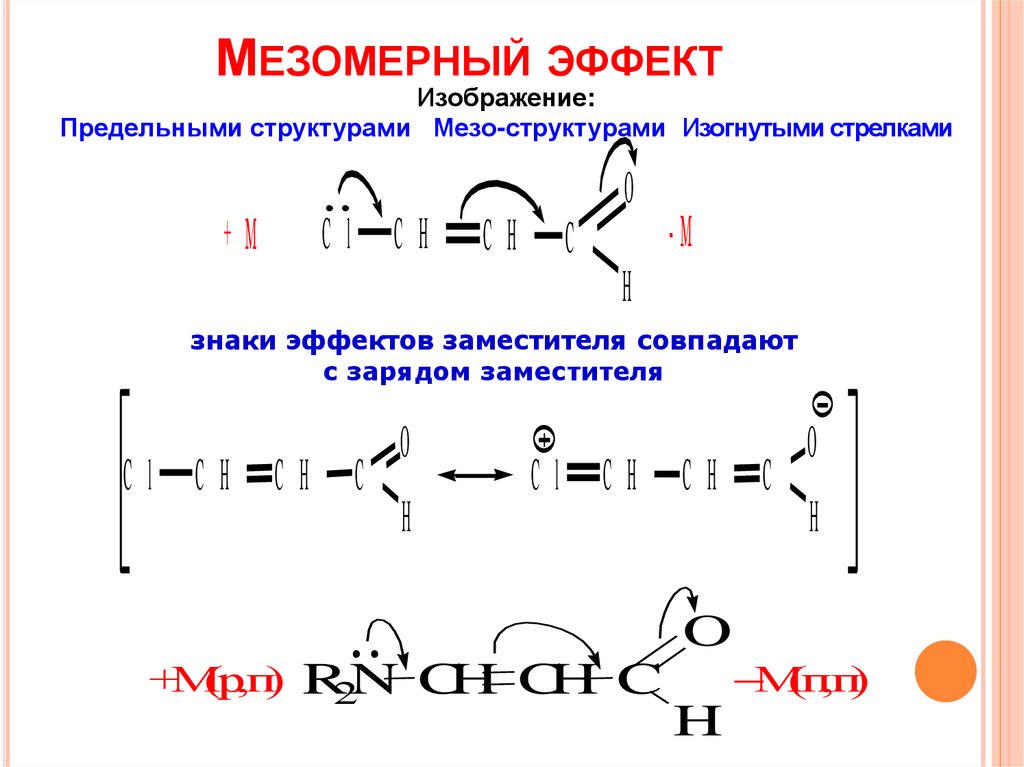
МЕЗОМЕРНЫЙ ЭФФЕКТИзображение:
Предельными структурами Мезо-структурами Изогнутыми стрелками
O
+М
Cl CH
CH
C
-М
H
знаки эффектов заместителя совпадают
с зарядом заместителя
Cl CH
CH
C
O
Cl CH
CH
H
H
O
+M(р,п) R2N CH CH C
C
O
H
M(п,п)
7.
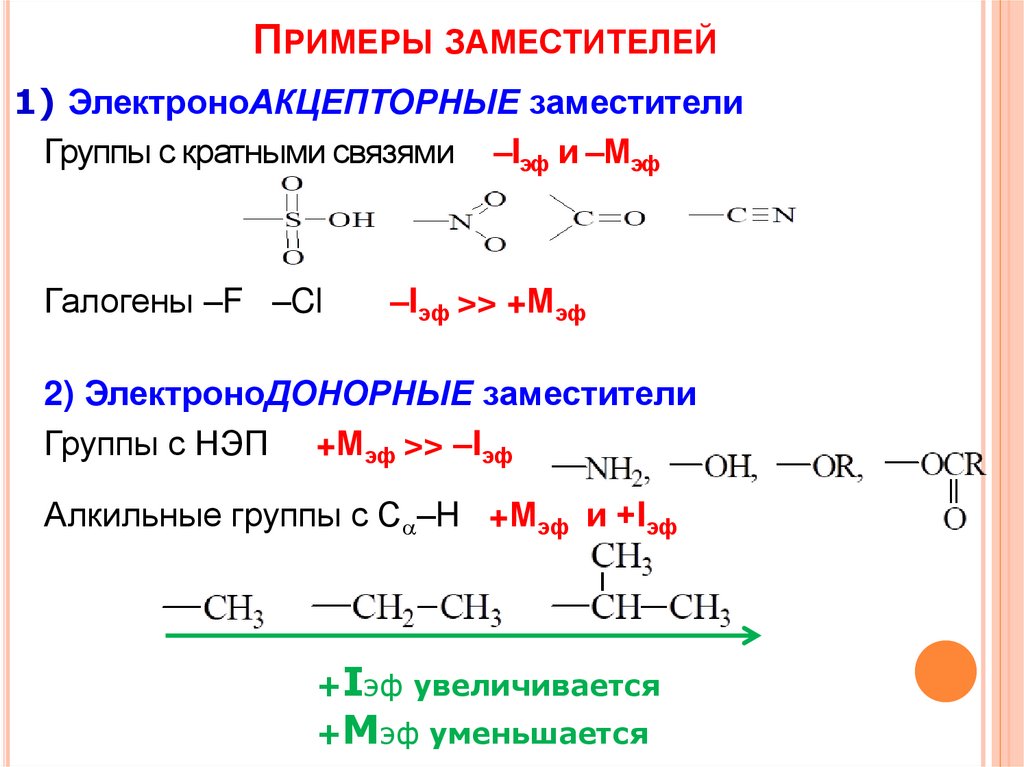
ПРИМЕРЫ ЗАМЕСТИТЕЛЕЙ1) ЭлектроноАКЦЕПТОРНЫЕ заместители
Группы с кратными связями –Iэф и –Мэф
Галогены –F –Cl
–Iэф >> +Мэф
2) ЭлектроноДОНОРНЫЕ заместители
Группы с НЭП +Мэф >> –Iэф
Алкильные группы с C –H +Мэф и +Iэф
+Iэф увеличивается
+Мэф уменьшается
8.
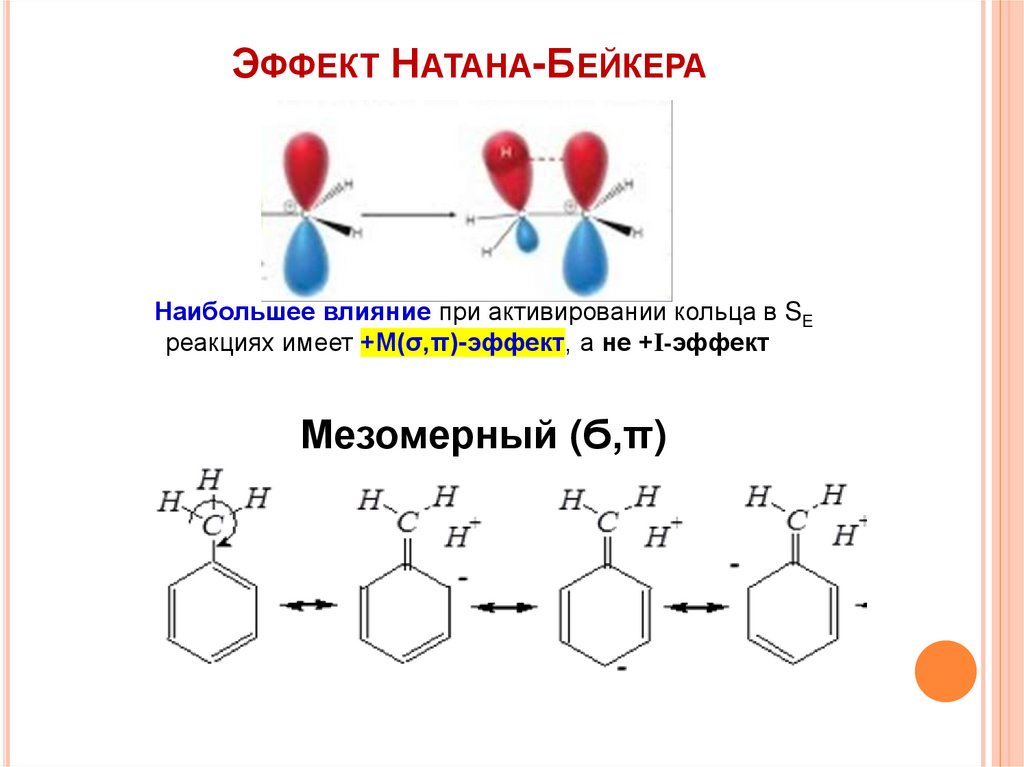
ЭФФЕКТ НАТАНА-БЕЙКЕРАНаибольшее влияние при активировании кольца в SE
реакциях имеет +М(σ,π)-эффект, а не +I-эффект
Мезомерный (Ϭ,π)
9.
СТАТИЧЕСКИЙ И ДИНАМИЧЕСКИЙ ФАКТОРЫРЕАКЦИОННОЙ СПОСОБНОСТИ
Правило Марковникова – статический фактор
δ́+
δ́+
H
H
H
δ+
δ-
C
CH
CH
пропилен
2
Статический фактор –
объяснение реакционной
способности до реакции,
т.е. в статике
Реакции присоединения
должны идти по правилу Марковникова
δ-
O
δ+
R 2C = C H -C = O
R
R 2C -C H = C -O
R
R 2C = C H -C = O
R
R 2C -C H -C H
δ+ R
2 электроф ильны х
ц ентра
10.
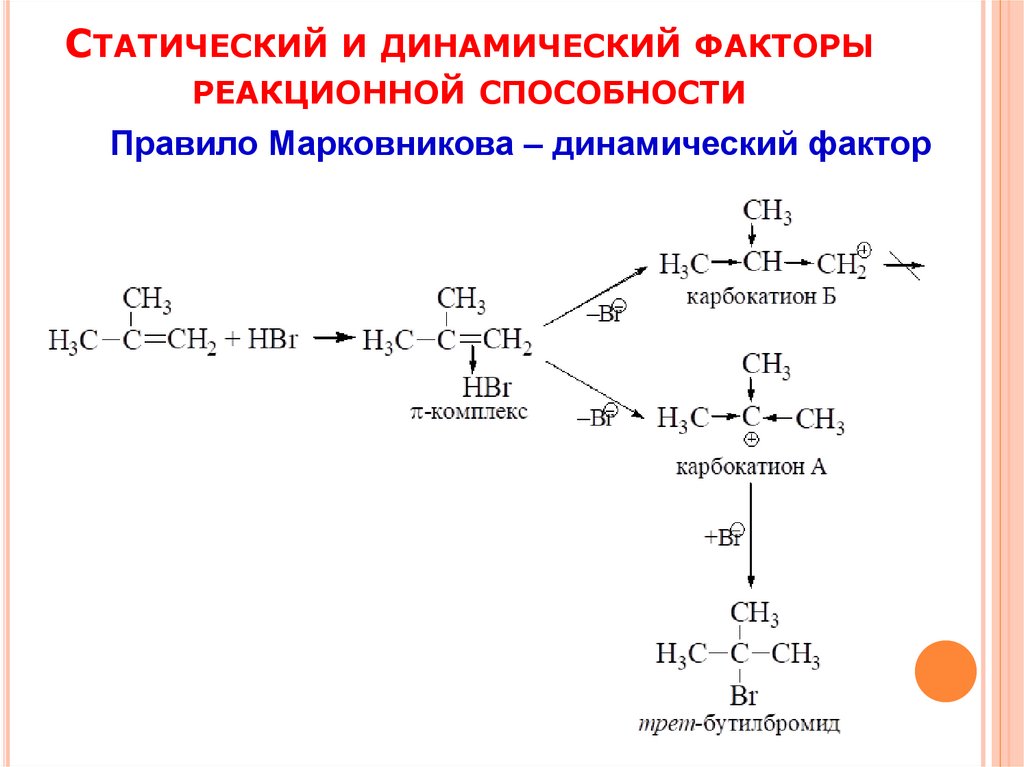
СТАТИЧЕСКИЙИ ДИНАМИЧЕСКИЙ ФАКТОРЫ
РЕАКЦИОННОЙ СПОСОБНОСТИ
Правило Марковникова – динамический фактор
11.
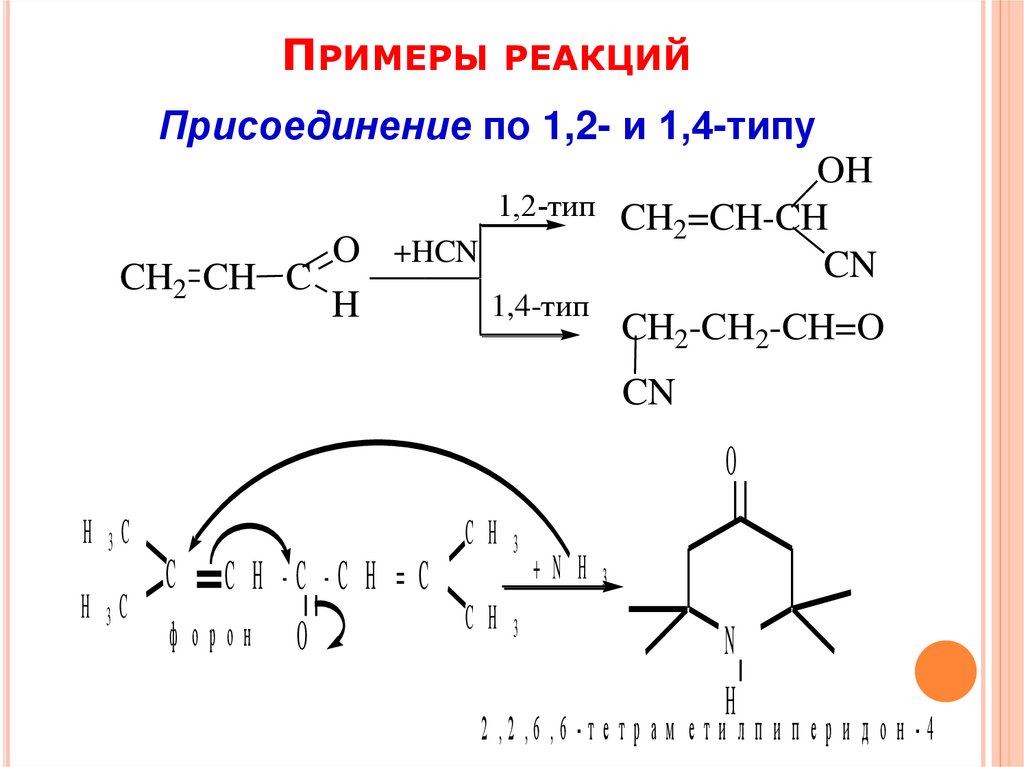
ПРИМЕРЫ РЕАКЦИЙПрисоединение по 1,2- и 1,4-типу
OH
1,2-тип CH =CH-CH
2
O +HCN
CN
CH2 CH C
1,4-тип
H
CH2-CH2-CH=O
CN
O
H 3C
H 3C
C H
3
+N H
C H -C -C H = C
C H 3
ф орон O
C
3
N
H
2 ,2 ,6 ,6 - т е т р а м е т и л п и п е р и д о н - 4
12.
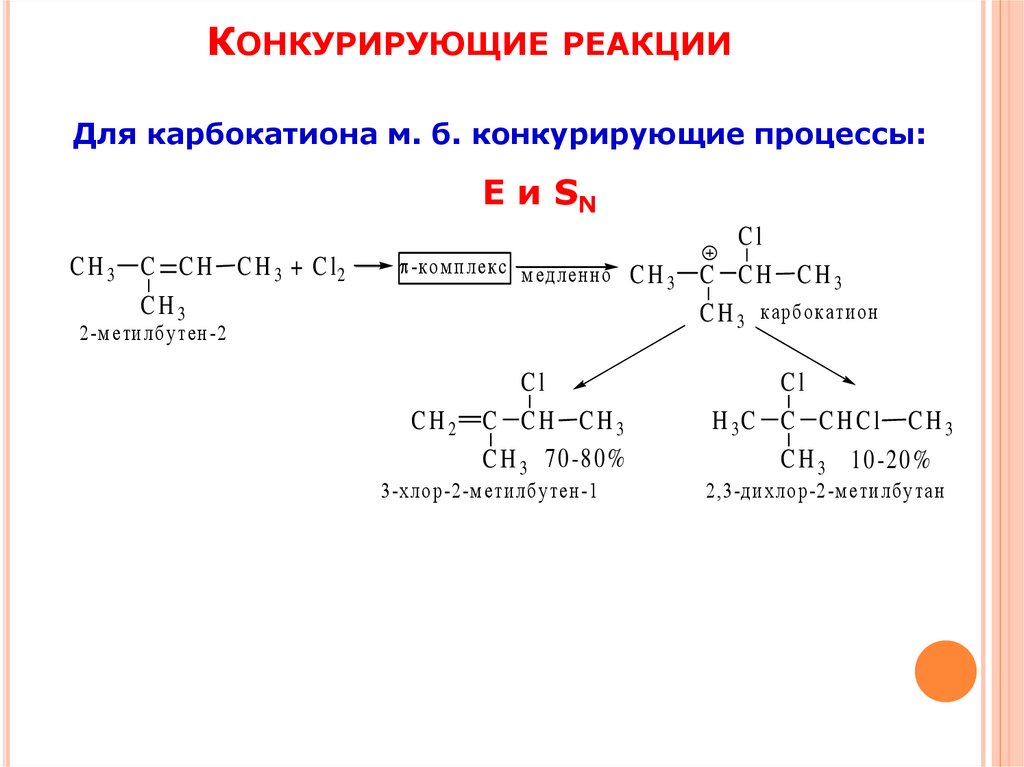
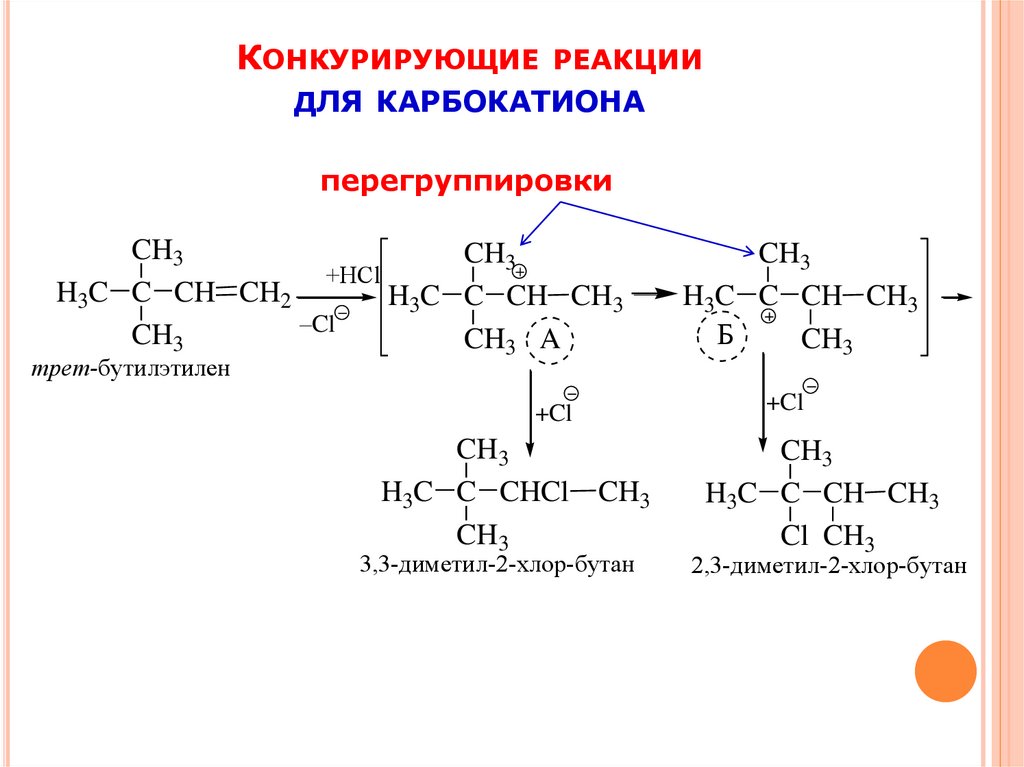
КОНКУРИРУЮЩИЕ РЕАКЦИИДля карбокатиона м. б. конкурирующие процессы:
Е и SN
C H 3 C C H C H 3 + C l2
CH3
-ко м п л екс м ед л ен но C H
3
2 -м е ти л б у тен -2
CH2
Cl
C CH CH3
C H 3 7 0 -8 0 %
3 -х л о р -2-м етил б у тен -1
Cl
C CH CH3
C H 3 карб окати о н
Cl
H 3C C C H C l C H 3
C H 3 1 0 -2 0 %
2 ,3-д и хл о р -2 -м ети л бу та н
13.
КОНКУРИРУЮЩИЕРЕАКЦИИ
ДЛЯ КАРБОКАТИОНА
перегруппировки
CH3
CH3
+HCl
H3C C CH CH2
H3C C CH CH3
–Cl
CH3
CH3 A
трет-бутилэтилен
+Cl
CH3
H3C C CHCl CH3
CH3
3,3-диметил-2-хлор-бутан
CH3
H3C C CH CH3
Б
CH3
+Cl
CH3
H3C C CH CH3
Cl CH3
2,3-диметил-2-хлор-бутан
14.
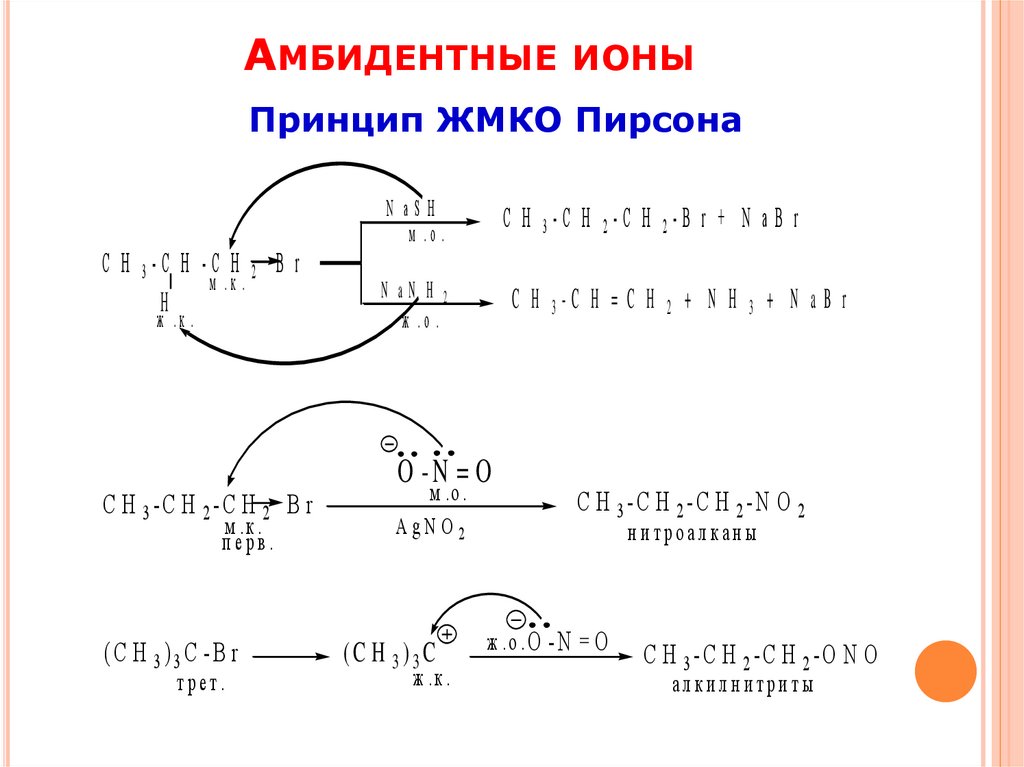
АМБИДЕНТНЫЕ ИОНЫПринцип ЖМКО Пирсона
N aSH
м .о .
С Н 3-С Н -С Н 2 B r
м .к .
H
ж .к .
С Н 3-С Н 2-С Н 2 B r
м .к .
перв.
(C H 3)3C -B r
трет.
C H 3-C H 2-C H 2-B r + N a B r
N aN H 2
ж .о .
C H 3-C H = C H
O -N = O
м .о .
A gN O 2
(C H 3)3C
ж .к .
2
+ N H
3
+ N aB r
C H 3-C H 2-C H 2-N O 2
н и троалкан ы
ж .о . O - N
=O
C H 3-C H 2-C H 2-O N O
алкилнитриты
15.
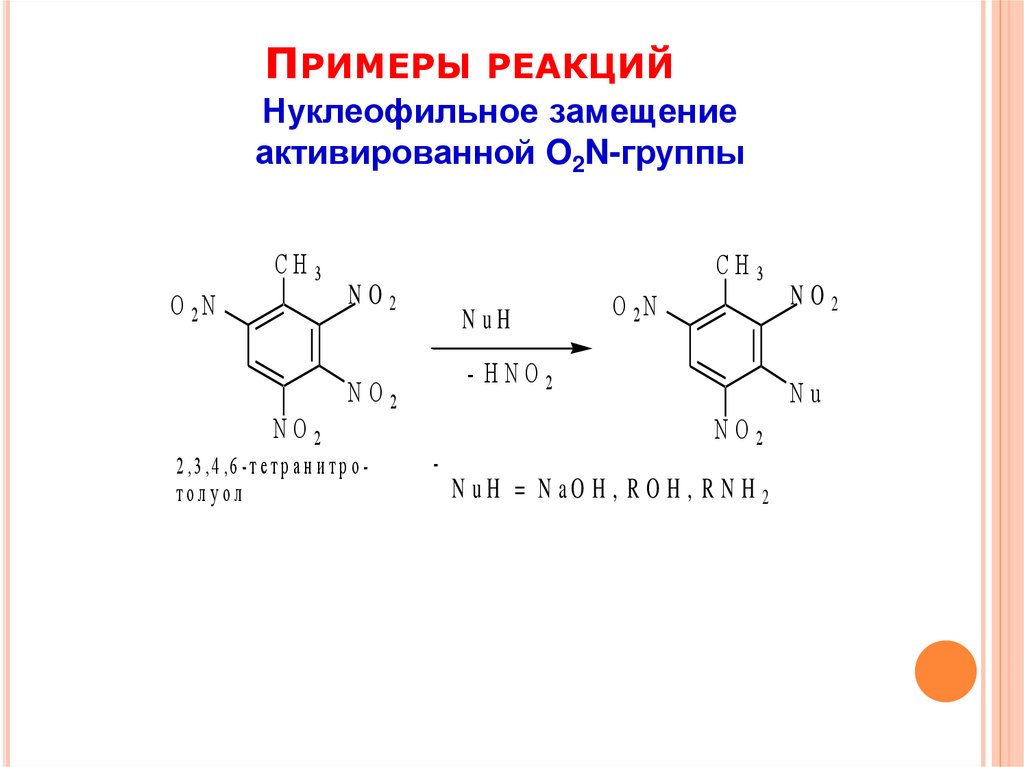
ПРИМЕРЫРЕАКЦИЙ
Нуклеофильное замещение
активированной O2N-группы
СН3
O 2N
NO2
NO2
NO2
2 ,3 , 4 ,6 - т е т р а н и т р о толу ол
СН3
N uH
O 2N
- HNO2
NO2
Nu
NO2
N uH = N aO H , R O H , R N H 2
16.
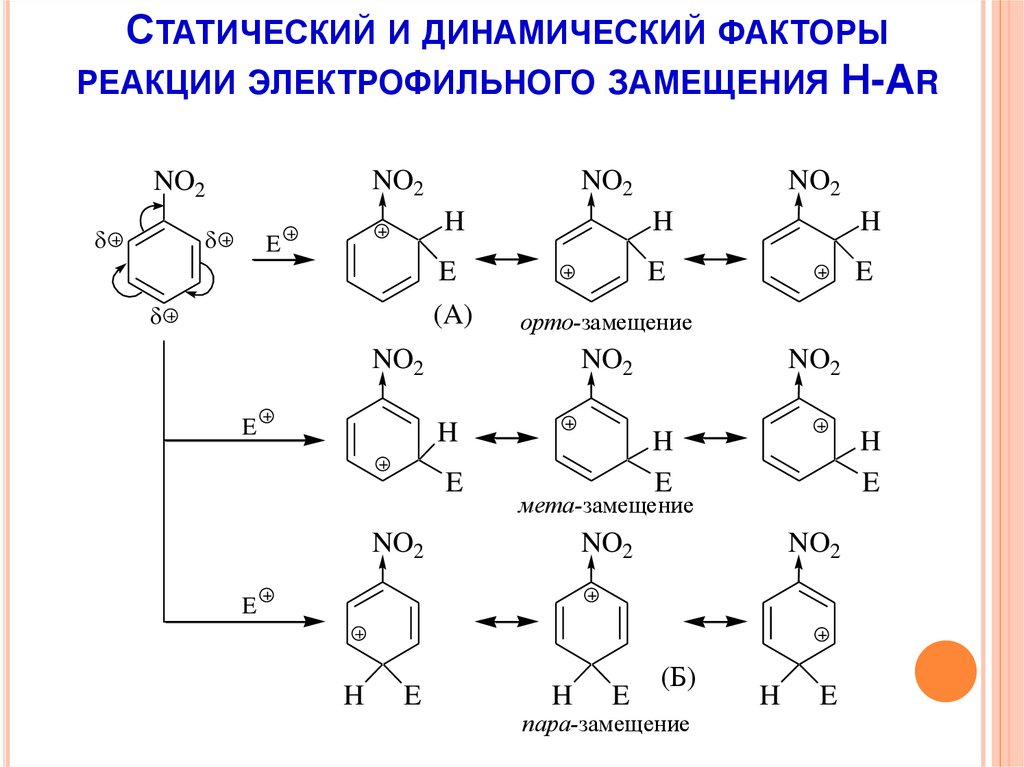
СТАТИЧЕСКИЙ И ДИНАМИЧЕСКИЙ ФАКТОРЫРЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ Н-AR
NO2
NO2
E
NO2
H
H
H
E
E
E
(A)
орто-замещение
NO2
E
NO2
NO2
H
E
NO2
H
E
H
E
мета-замещение
NO2
NO2
NO2
E
H
E
H
E
(Б)
пара-замещение
H
E
17.
СТАТИЧЕСКИЙ И ДИНАМИЧЕСКИЙ ФАКТОРЫРЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ AR-Х
Для 2,3,4,6-тетранитротолуола:
(доска)
ВЫВОД:
При планировании незнакомой реакции
нужно обязательно оценивать:
а) статический фактор реакции
б) динамический фактор реакции
в) стерические факторы
18.
СТЕРЕОХИМИЯПоляриметры:
1 - монохроматический свет
2, 4 - призма Николя из исландского шпата
3 – раствор, 5 – измерение=шкала
Измеряют удельное вращение:
[α] – удельное вращение, α – угол вращения,
l – длина кюветы (дм), t – температура в °С
с – конц., г/100 мл раствора, λ – длина волны
19.
СТЕРЕОХИМИЯХиральность - способность соединений
существовать в виде пары несовместимых
зеркальных изображений - стереоизомеров.
Хиральный центр – чаще атом с четырьмя
разными заместителями (ассиметрический атом).
Энантиомеры – стереоизомеры несовместимые
друг с другом.
Рацемат, рацемическая форма –
эквимолекулярная смесь энантиомеров,
оптически неактивна.
Диастереомеры – стереоизомеры, не
являющиеся энантиомерами.
20.
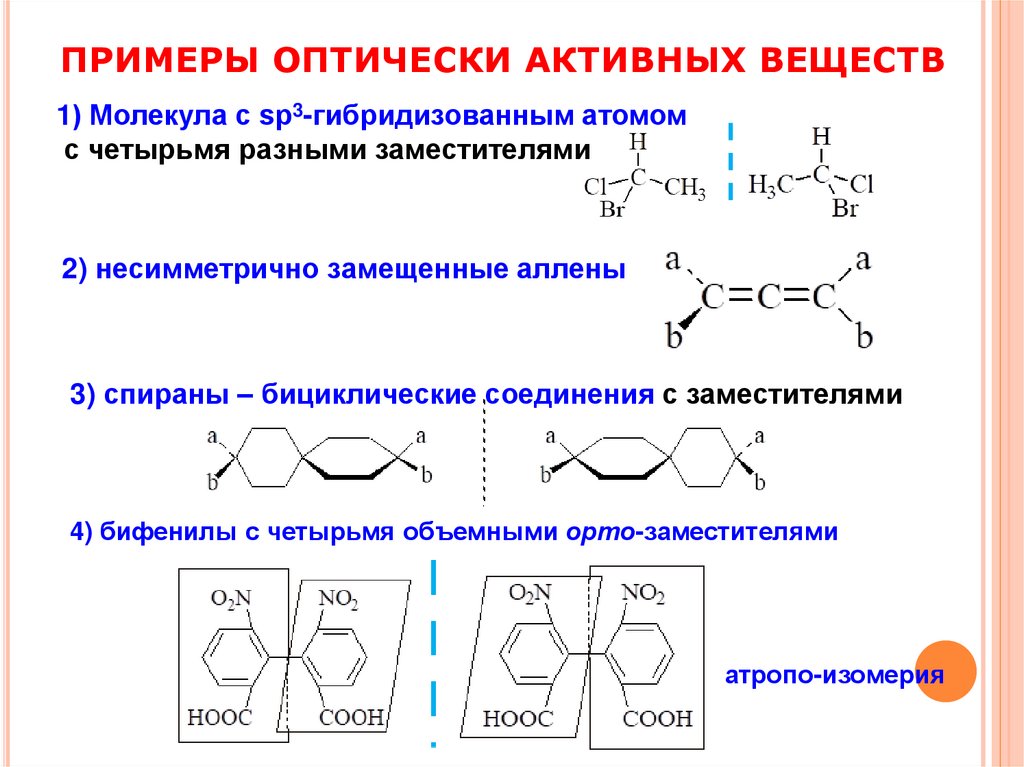
ПРИМЕРЫ ОПТИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ1) Молекула с sp3-гибридизованным атомом
с четырьмя разными заместителями
2) несимметрично замещенные аллены
3) спираны – бициклические соединения с заместителями
4) бифенилы с четырьмя объемными орто-заместителями
атропо-изомерия
21.
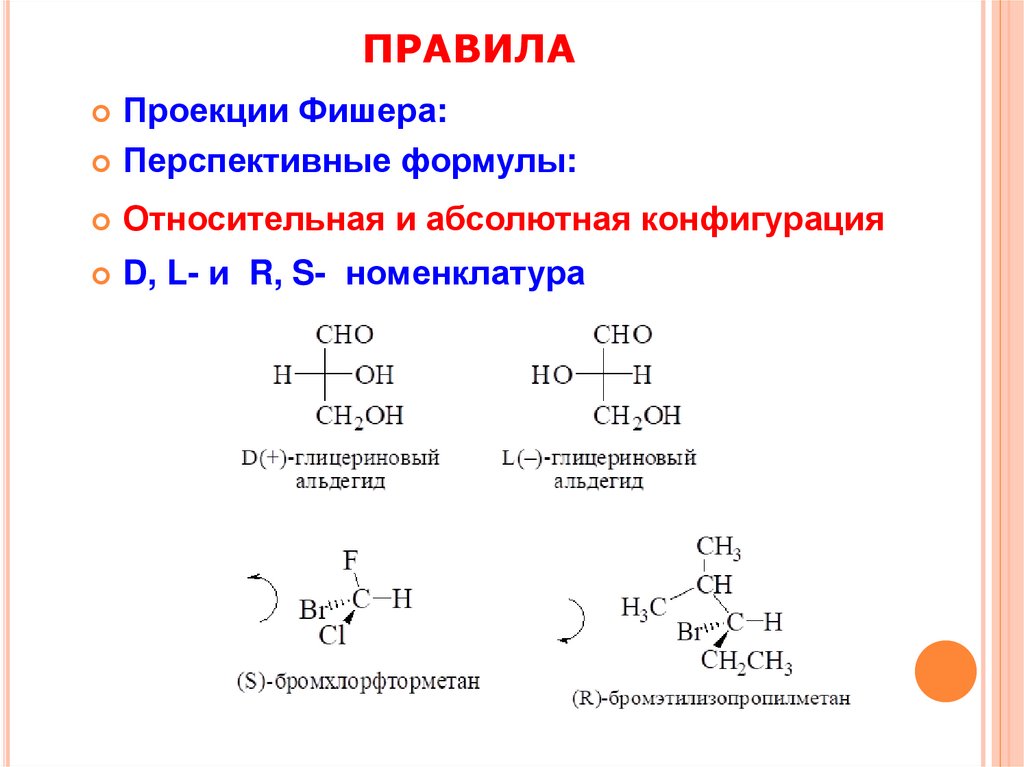
ПРАВИЛАПроекции Фишера:
Перспективные формулы:
Относительная и абсолютная конфигурация
D, L- и R, S- номенклатура
22.
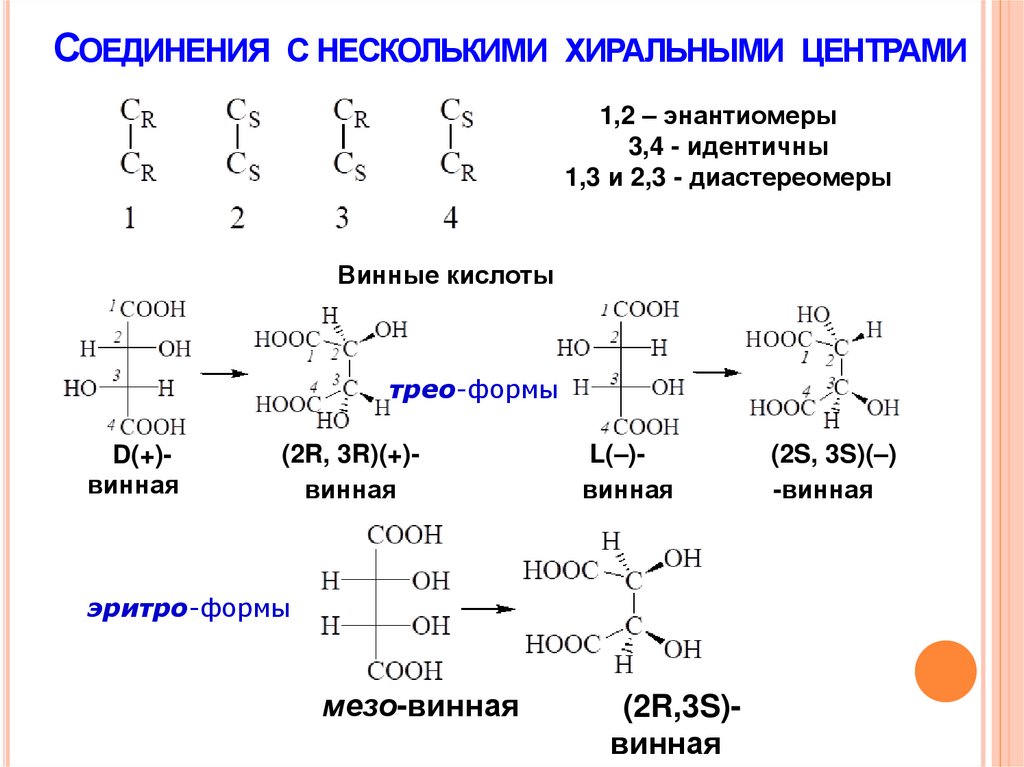
СОЕДИНЕНИЯ С НЕСКОЛЬКИМИ ХИРАЛЬНЫМИ ЦЕНТРАМИ1,2 – энантиомеры
3,4 - идентичны
1,3 и 2,3 - диастереомеры
Винные кислоты
трео-формы
D(+)винная
(2R, 3R)(+)винная
L(–)винная
эритро-формы
мезо-винная
(2R,3S)винная
(2S, 3S)(–)
-винная
23.
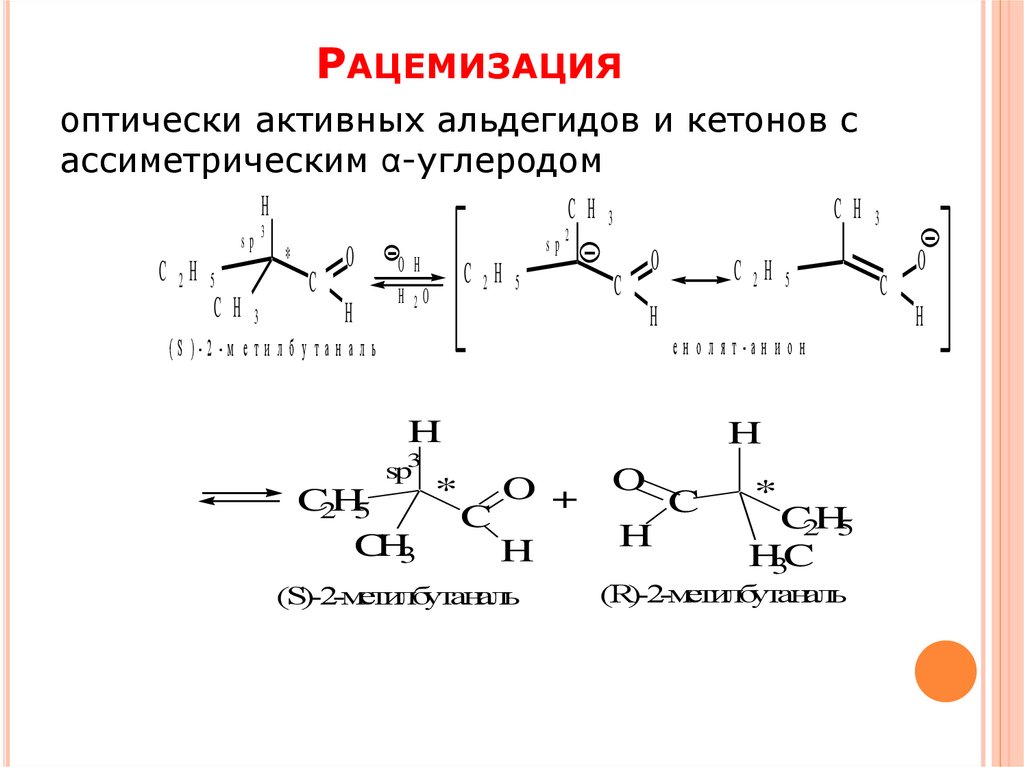
РАЦЕМИЗАЦИЯоптически активных альдегидов и кетонов с
ассиметрическим α-углеродом
sp
C 2H
C H
2
*
5
C H
H
3
3
C
O
H
sp
O H
H 2O
C 2H
5
C H
3
C
O
C 2H
5
H
H
sp3
* O +
C2H5
C
CH3
H
(S)-2-метилбутаналь
H
O
H
C
O
H
ен о л я т-ан и о н
(S )-2 -м е т и л б у т а н а л ь
3
C
*
C2H5
H3C
(R)-2-метилбутаналь
24.
ЗАДАЧА 1, 2Из ацетилена, этилбромида и других необходимых
реагентов получите мезо-гександиол-3,4.
Приведите формулы Фишера, Ньюмена и
клиновидные проекции, определите R,Sконфигурации асимметрических атомов углерода.
Из транс-бутена-2 других необходимых реагентов
получите мезо-С4Н8D2.
Приведите формулы Фишера, Ньюмена и
клиновидные проекции, определите R,Sконфигурации асимметрических атомов углерода.
Чем отличается продукт бромирования от
дейтерирования?
25.
ЗАДАЧА 3Дикарбоновая кислота А (С9Н1404), в молекуле которой
карбоксильные группы максимально удалены друг от друга,
обесцвечивает бромную воду.
Обработка А хромовой смесью приводит к двум кислотам - В,
С.
Соль кислоты В не способна присоединять HCN в присутствии
основания.
При нагревании кислота В легко теряет воду и превращается в
вещество D (С4Н403), сходное по строению с продуктом окисления
бензола кислородом в присутствии V205 при 500°С.
Соль кислоты С в присутствии основания может присоединять
HCN с образованием Е, но не дает реакции серебряного зеркала с
реактивом Толленса.
а) Установите строение веществ А-Е и напишите уравнения всех
упомянутых реакций,
б) Напишите формулы изомеров продукта, образующегося в
реакции между А и бромом,
в) Какое пространственное строение может иметь кислота А, дайте
названия этим изомерам по Z,E-номенклатуре.
г) Предложите простейшую модификацию структуры этого продукта,
приводящую к уменьшению числа изомеров.









 Химия
Химия








