Похожие презентации:
Многоядерные ароматические соединения
1.
Многоядерные ароматические соединения.Многоядерные (полициклические) ароматические соединения
подразделяются на четыре класса:
1) полициклические арены, связанные простой связью или
группировкой атомов (дифенил, дифенилметан, трифенилметан,
2,2-дифенилпропан);
2) конденсированные полициклические арены:
2.1) линейно конденсированные циклы (нафталин, антрацен)
2.2) ангулярно кондерсированные циклы (фенантрен)
2.3) периконденсированные циклы (пирен)
3'
4'
5'
2
2'
1' 1
6
6'
3
CH3
4
CH2
CH
C
CH3
5
10
8
8
1
9
9
1
7
2 7
2
6
3 6
3
5
4
5
10
4
1
9
7
2
5
4
3
3
8
1
8
6
2
10
7
4
6
5
1
2.
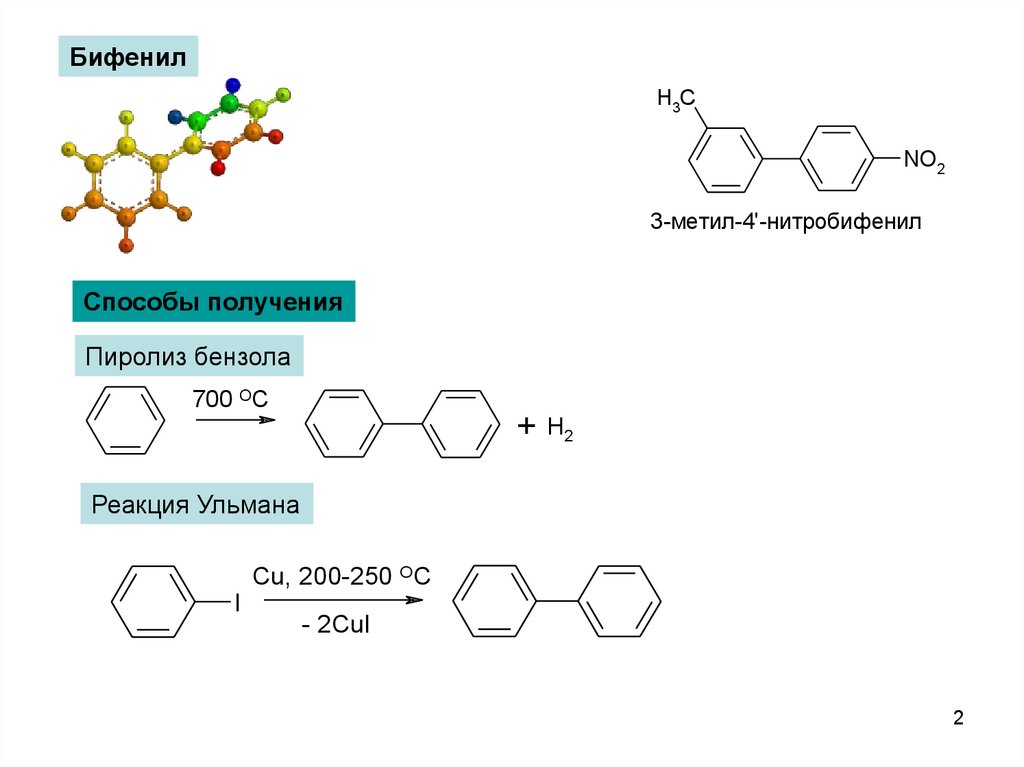
БифенилH3C
NO2
3-метил-4'-нитробифенил
Способы получения
Пиролиз бензола
700 OC
+
H2
Реакция Ульмана
Cu, 200-250 OC
I
- 2CuI
2
3.
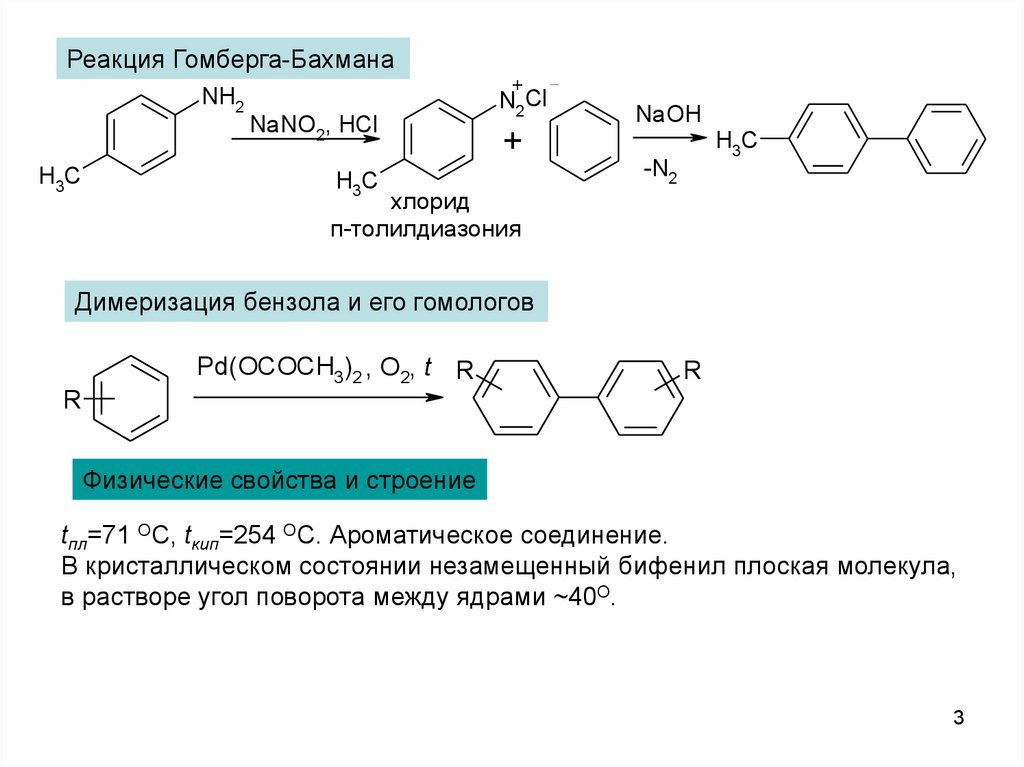
Реакция Гомберга-БахманаNH2
H3C
+
NaNO2, HCl
N2 Cl
+
H3C
хлорид
п-толилдиазония
NaOH
H3C
-N2
Димеризация бензола и его гомологов
Pd(OCOCH3)2 , O2, t R
R
R
Физические свойства и строение
tпл=71 OC, tкип=254 OC. Ароматическое соединение.
В кристаллическом состоянии незамещенный бифенил плоская молекула,
в растворе угол поворота между ядрами ~40О.
3
4.
Атропоизмерия2-изо-пропилбифенил
COOH
O2N
HOOC
NO2
HOOC
NO2
COOH
O2N
Вращение ароматических колец затруднено.
Бифенил – ароматическое термостабильное соединение.
Для проведения реакции при высокой температуре используется
эвтектическая смесь, состоящая из бифенила (26,5%) и дифенилового эфира
(73,5%), известная под названием «даутерм А» (dowtherm A).
Температура кипения этой смеси равна 258 оC.
4
5.
Химические свойстваРеакции SEAr
Галогенирование протекает в присутствии катализаторов - кислот Льюиса:
Cl
Cl 2,AlCl 3
Cl
4-хлорбифенил
Cl 2,AlCl 3
+
2-хлорбифенил
Cl
Монобромирование БФ проходит
при обработке твердого БФ парами
брома при комнатной температуре.
Cl + Cl
Cl
2,4'-дихлорбифенил
4,4'-дихлорбифенил
Нитрование бифенила проводят нитрующей смесью:
NO 2
HNO 3 + H 2SO 4
NO 2 +
HNO 3 + H 2SO 4
4-нитробифенил
NO 2
NO 2 + NO 2
NO 2
4,4'-динитробифенил
2,4'-динитробифенил
5
6.
ДифенилметанH
3'
C
1'
4'
H
2
2'
5'
6'
CH2
3
1
4
6
5
Способы получения
Реакция алкилирования
CH2Cl
AlCl3
+
R
R1
R1
R
Восстановление бензофенона
CO
[H]
CH2
[H] = Zn(Hg), HCl
NH2NH2, KOH
6
7.
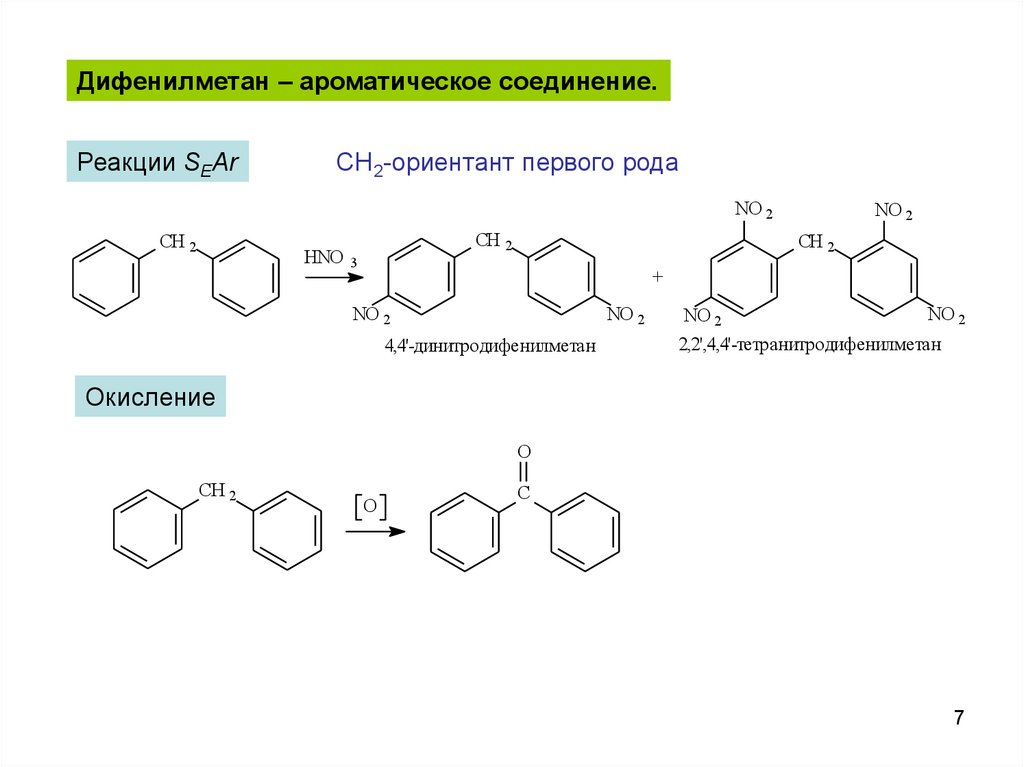
Дифенилметан – ароматическое соединение.Реакции SEAr
CH2-ориентант первого рода
NO 2
CH 2
HNO
CH 2
NO 2
CH 2
3
+
NO 2
NO 2
4,4'-динитродифенилметан
NO 2
NO 2
2,2',4,4'-тетранитродифенилметан
Окисление
O
CH 2
O
C
7
8.
ТрифенилметанH
C
Способы получения
H
3
+
CHCl3
AlCl3
C
8
9.
Трифенилметан – ароматическое соединение. Характерные реакции SEArРеакции C-H связи
C
H + Na
NH 2
C
3
Na + NH 3
3
кислота более сильная,
чем аммиак
трифенилметанид-анион
Строение аниона трифенилметана.
_
_
'
_
'
_
_
'
_
'
_
'
C
_
_
'
9
10.
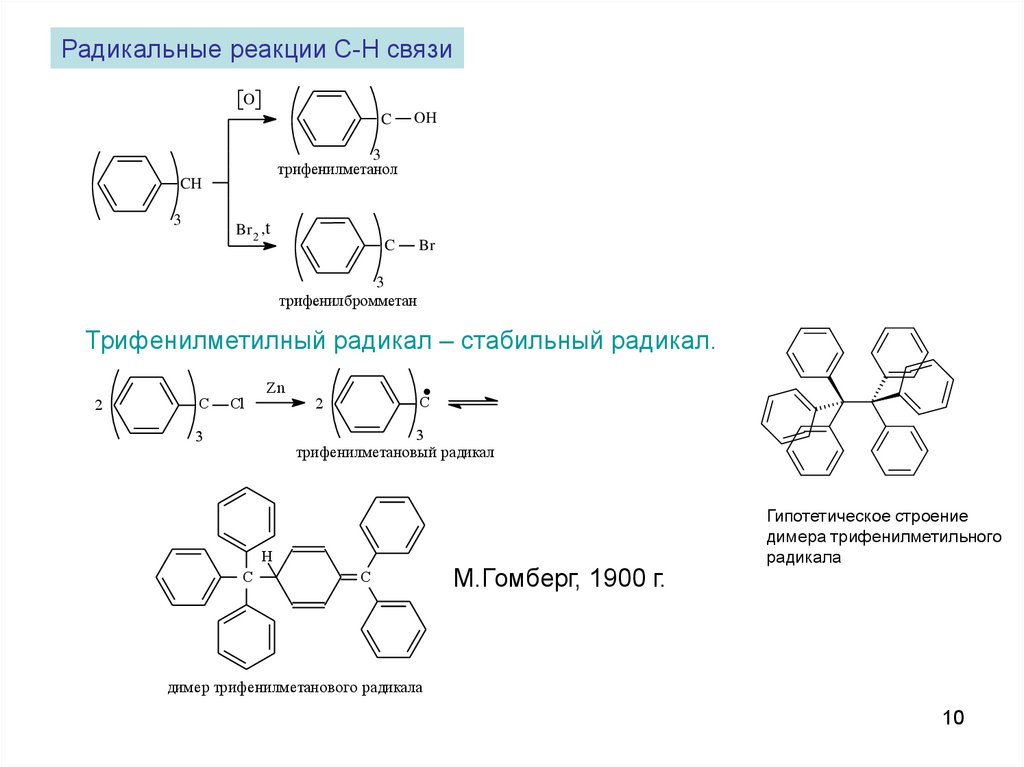
Радикальные реакции C-H связиO
C
OH
3
трифенилметанол
CH
3
Br 2 ,t
C
Br
3
трифенилбромметан
Трифенилметилный радикал – стабильный радикал.
2
С
Cl
Zn
С
2
3
трифенилметановый радикал
3
H
C
C
М.Гомберг, 1900 г.
Гипотетическое строение
димера трифенилметильного
радикала
димер трифенилметанового радикала
10
11.
Строение радикала трифенилметана.'
'
'
'
'
'
C
Строение катиона трифенилметана.
+
'+
'+
'+
+
+
C
'+
'+
+
'+
11
12.
1213.
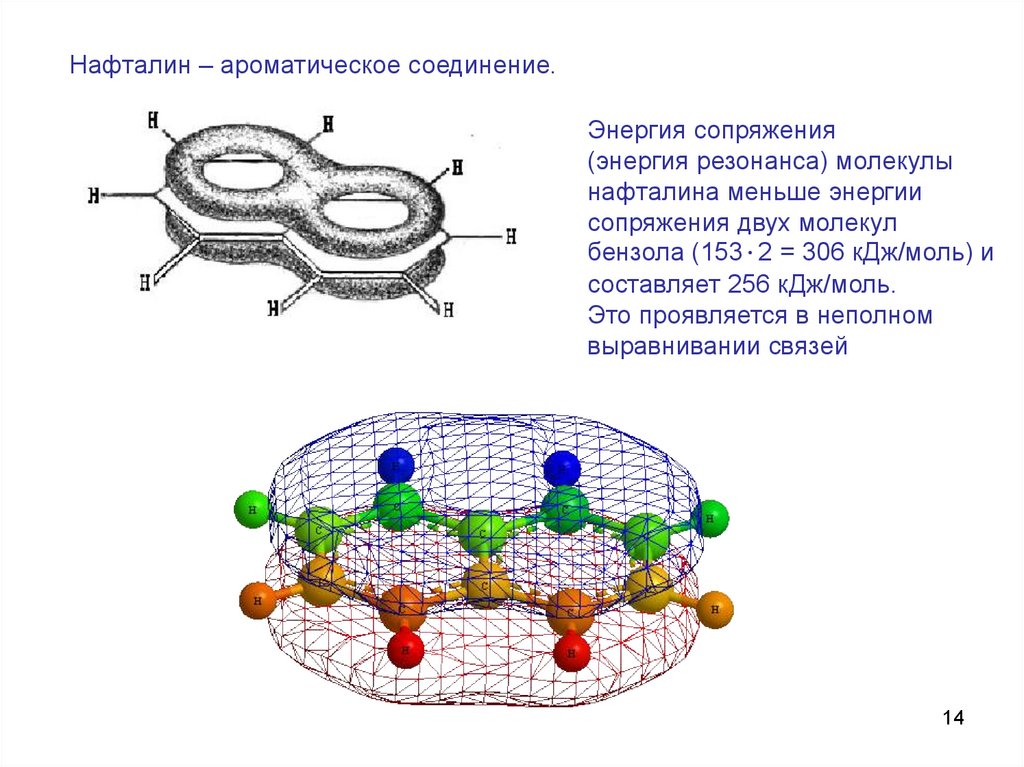
Конденсированные полициклические ареныНафталин
8
1
7
2
6
3
5
4
Способы получения
Основным источником нафталина служит каменноугольная смола
Физические свойства и строение молекулы
0,109нм
H
H
H
120 о
119,5 о
H
0,138нм
8
H
0,142нм
7
2
6
3
5
H
0,142нм
0,141нм
4
кратность 11./3
III
II
I
H
H
1
8
кратность 12/3.
1
7
2
3
6
5
4
13
14.
Нафталин – ароматическое соединение.Энергия сопряжения
(энергия резонанса) молекулы
нафталина меньше энергии
сопряжения двух молекул
бензола (153∙2 = 306 кДж/моль) и
составляет 256 кДж/моль.
Это проявляется в неполном
выравнивании связей
14
15.
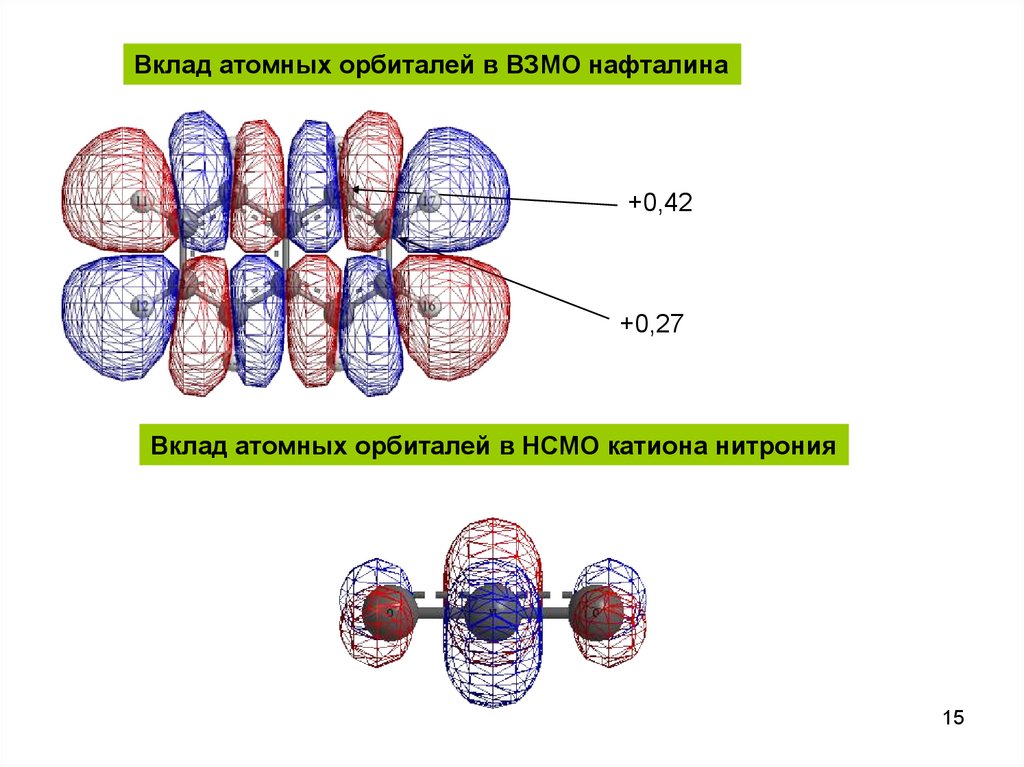
Вклад атомных орбиталей в ВЗМО нафталина+0,42
+0,27
Вклад атомных орбиталей в НСМО катиона нитрония
15
16.
Химические свойстваРеакции электрофильного замещения SEAr
Br
Br2, H2O, 40
H2O + Br2
OC
H
1-бромнафталин
-бромнафталин
HOBr + HBr
O Br Br
H
NO2
HNO3,H2SO4
1-нитронафталин
-нитронафталин
16
17.
HNO2+
Атака в -положение
H
NO2
NO2
+
I
II +
Наиболее устойчивы,ароматический секстет
сохраня ется , резонансная стабилизация 153 кДж/моль
H
NO2
H
NO2
+
H
+
NO2
+ III
IV
V
Менее устойчивы, ароматический секстет нарушен, вклад структур
незначительный
+
H
H
+
NO2
NO2
NO2
Атака в -поло+
жение
VI
VII
Наиболее устойчива,
ароматический секстет
сохраня ется
H
+
H
H
NO2
NO
NO
2
2
+
+
X
IX
VIII
Менее устойчивы, ароматический секстет нарушен, вклад структур незначительный
17
18.
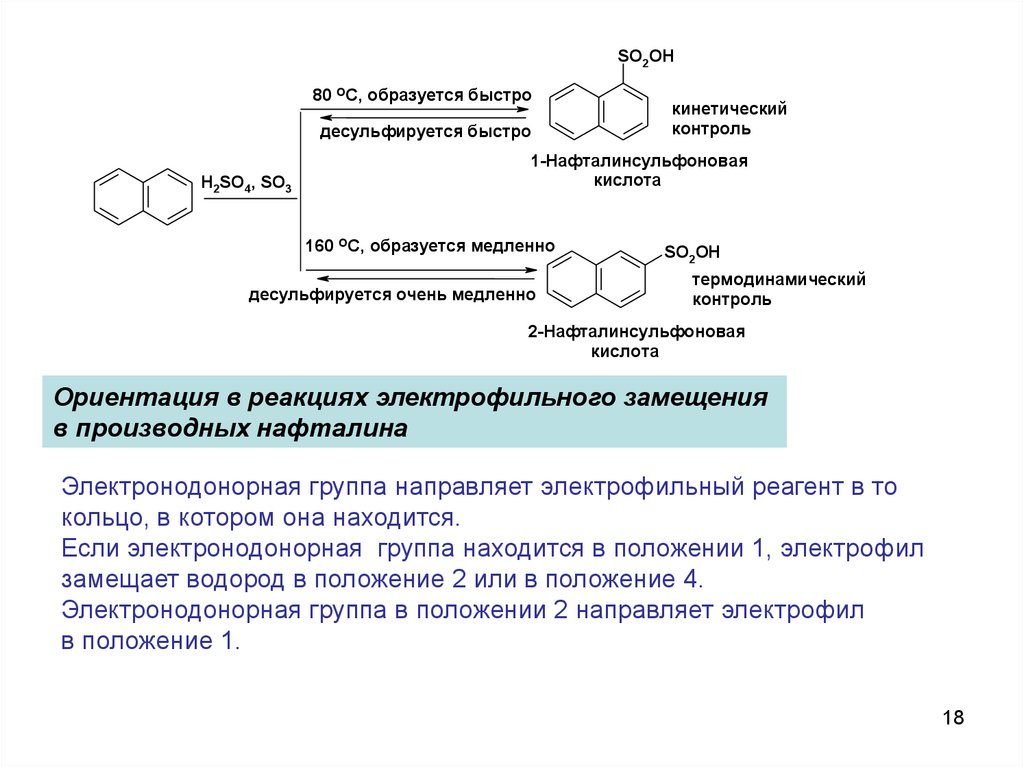
SO2OH80 ОС, образуется быстро
десульфируется быстро
H2SO4, SO3
кинетический
контроль
1-Нафталинсульфоновая
кислота
160 ОС, образуется медленно
десульфируется очень медленно
SO2OH
термодинамический
контроль
2-Нафталинсульфоновая
кислота
Ориентация в реакциях электрофильного замещения
в производных нафталина
Электронодонорная группа направляет электрофильный реагент в то
кольцо, в котором она находится.
Если электронодонорная группа находится в положении 1, электрофил
замещает водород в положение 2 или в положение 4.
Электронодонорная группа в положении 2 направляет электрофил
в положение 1.
18
19.
OHOH
+
HNO3
OH
NO2
H2SO4
+
NO2
4-Нитро-1-нафтол 2-Нитро-1-нафтол
(основной продукт)
Электроноакцепторная группа направляет электрофильный реагент в
другое незамещенное кольцо (в положение 5 или 8).
NO2
NO2
+
HNO3
H2SO4
NO2 NO2
+
NO2
1,5-Динитронафталин
1,8-Динитронафталин
19
20.
G+
G
E
+
H E
Электронодонорная группа
в большей степени участвует
в распределении положительного заря да, карбокатион
более устойчив
G
E
+
+
H E
Электронодонорная группа
в меньшей степени участвует
в распределении положительного заря да, карбокатион
менее устойчив
Восстановление и окисление нафталина
O
O2, V2O5, 450 OC
C
O
C
O
Фталевый ангидрид
20
21.
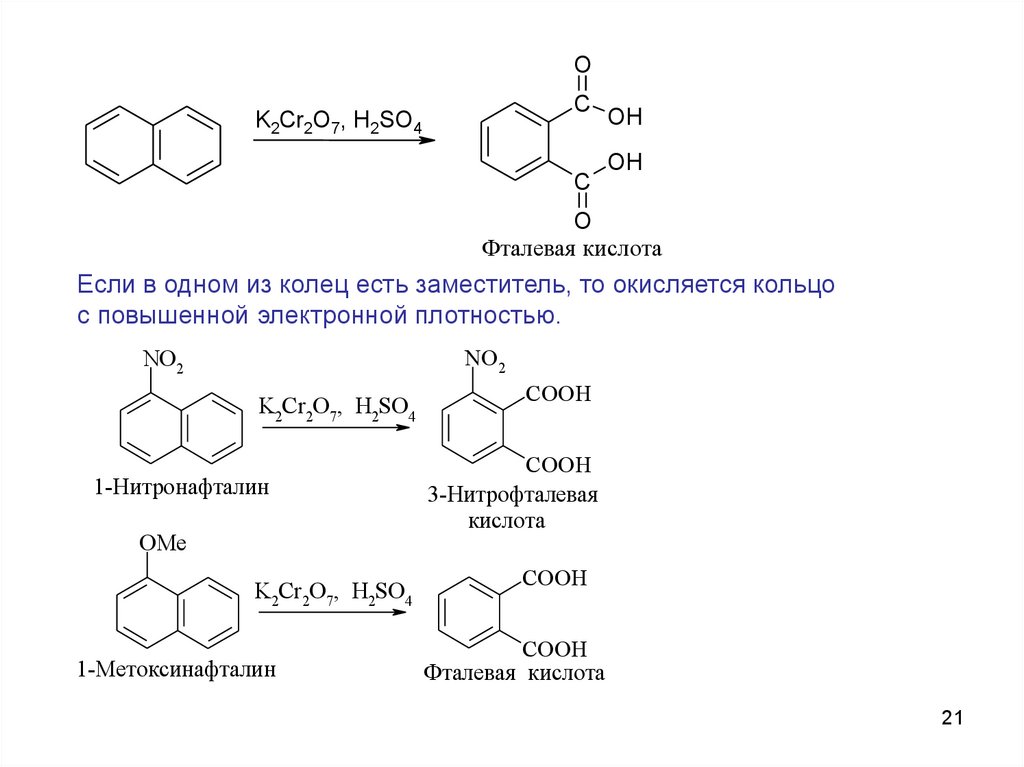
OC
K2Cr2O7, H2SO4
C
OH
OH
O
Фталевая кислота
Если в одном из колец есть заместитель, то окисляется кольцо
с повышенной электронной плотностью.
NO2
NO2
K2Cr2O7, H2SO4
1-Нитронафталин
OMe
K2Cr2O7, H2SO4
1-Метоксинафталин
COOH
COOH
3-Нитрофталевая
кислота
COOH
COOH
Фталевая кислота
21
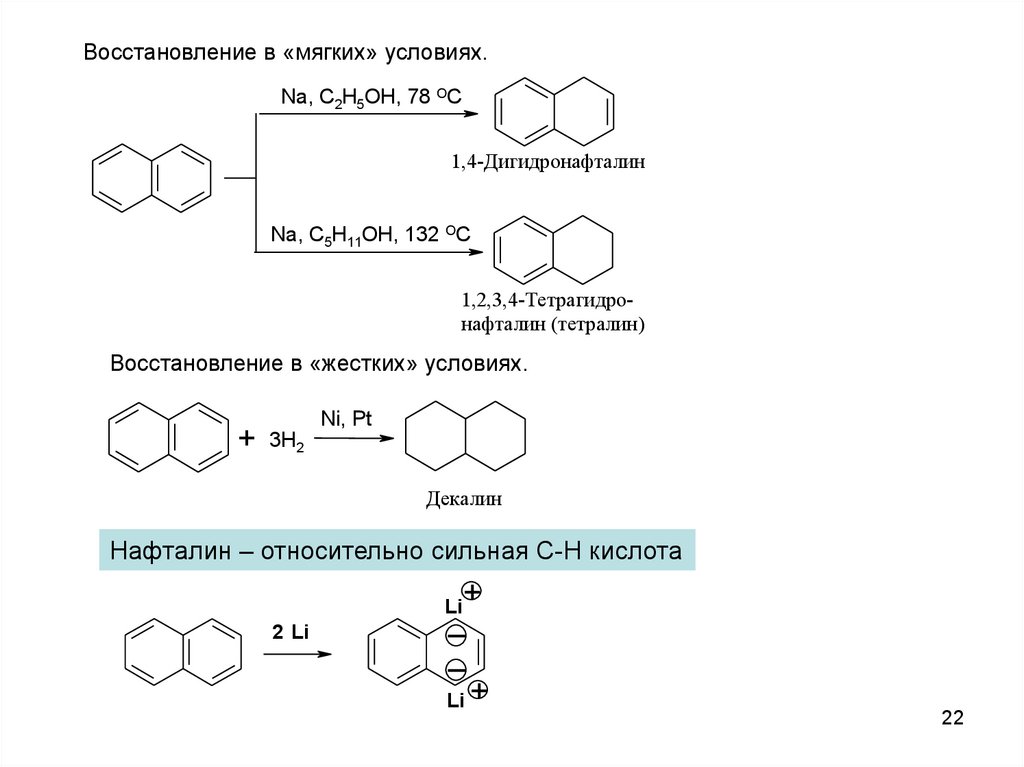
22.
Восстановление в «мягких» условиях.Na, C2H5OH, 78 OC
1,4-Дигидронафталин
Na, C5H11OH, 132 OC
1,2,3,4-Тетрагидронафталин (тетралин)
Восстановление в «жестких» условиях.
+
Ni, Pt
3H2
Декалин
Нафталин – относительно сильная C-H кислота
Li
+
2 Li
Li +
22
23.
Антрацен и фенантрен8
9
9
1
7
2
6
3
5
10
1
8
2
7
4
6
Антрацен
5
4
Ароматические
соединения
3
Фенантрен
II
I
III
IV
V
VII
10
Энергия резонанса
составляет 386 кДж/моль.
VI
VIII
Энергия резонанса
составляет 352 кДж/моль.
Реакционная способность
антрацена ниже, чем фенантрена
IX
23
24.
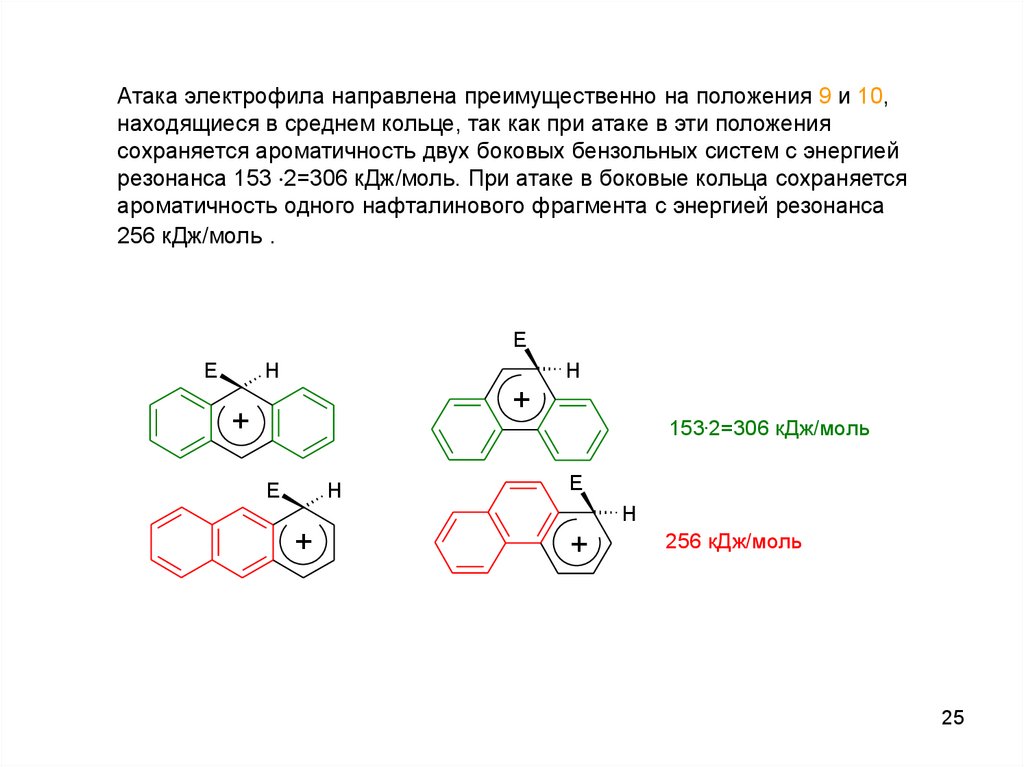
2425.
Атака электрофила направлена преимущественно на положения 9 и 10,находящиеся в среднем кольце, так как при атаке в эти положения
сохраняется ароматичность двух боковых бензольных систем с энергией
резонанса 153 2=306 кДж/моль. При атаке в боковые кольца сохраняется
ароматичность одного нафталинового фрагмента с энергией резонанса
256 кДж/моль .
E
E
H
H
+
+
E
H
153.2=306 кДж/моль
E
H
+
+
256 кДж/моль
25
26.
OBr
K2Cr2O7, H2SO4
Br2, CCl4
O
9,10-Антрахинон
9-Бромантрацен
Br
Антрацен
CH2
Na, C2H5OH
Br2, CCl4
CH2
9,10-Дигидроантрацен
9-Бромфенантрен
O
O
O
+
O
K2Cr2O7, H2SO4
O
O
O
9,10-Фенантренхинон
H2C CH2
O
Na, C2H5OH
+
Na
9,10-Дигидрофенантрен
2 Na
Na +
26















 Химия
Химия








