Похожие презентации:
Качественные реакции на ионы железа Fe2+ и Fe3+
1.
2.
План урока1. Проверка домашнего задания по теме:
«Железо, строение его атома,
физические и химические свойства»
2. Изучение нового материала
3. Лабораторный практикум
4. Подведение итогов
3.
Проверка домашнего задания1. Положение железа в Периодической системе
Д.И. Менделеева и электронное строение его атома.
2. Химические свойства железа.
3. Физические свойства железа.
4.
Тема урока:«Качественные реакции на ионы железа Fe2+ и Fe3+»
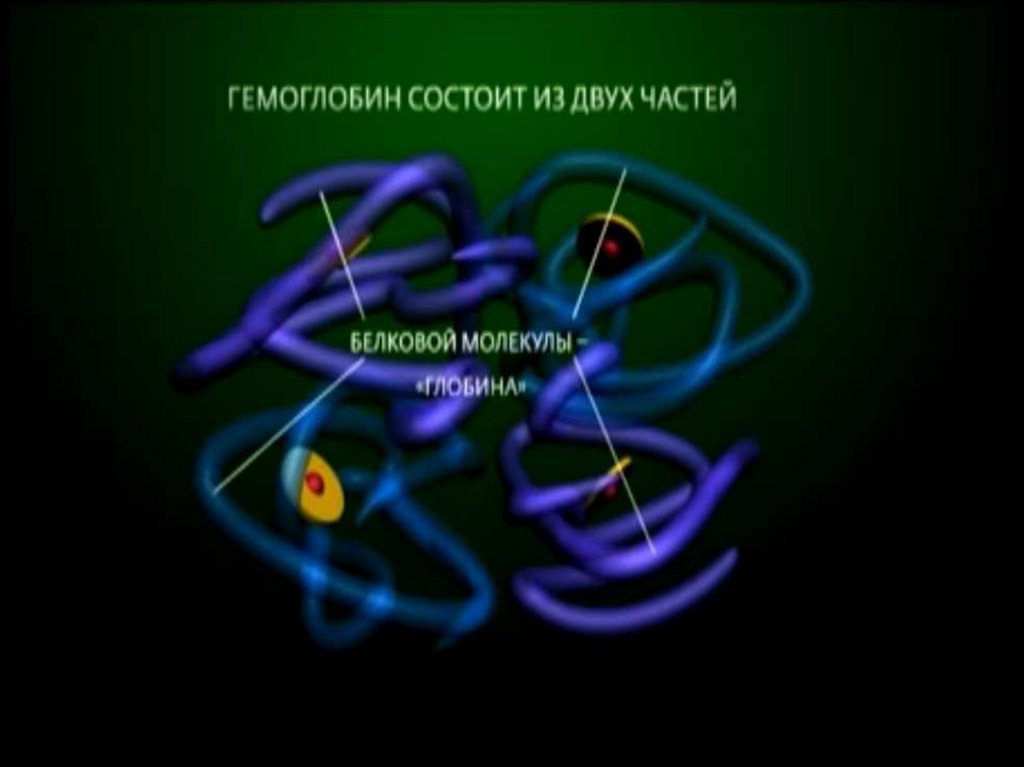
1.Биологическая роль железа
2. Соединения железа(II) и железа(III)
3. Применение железа
5.
6.
7.
8.
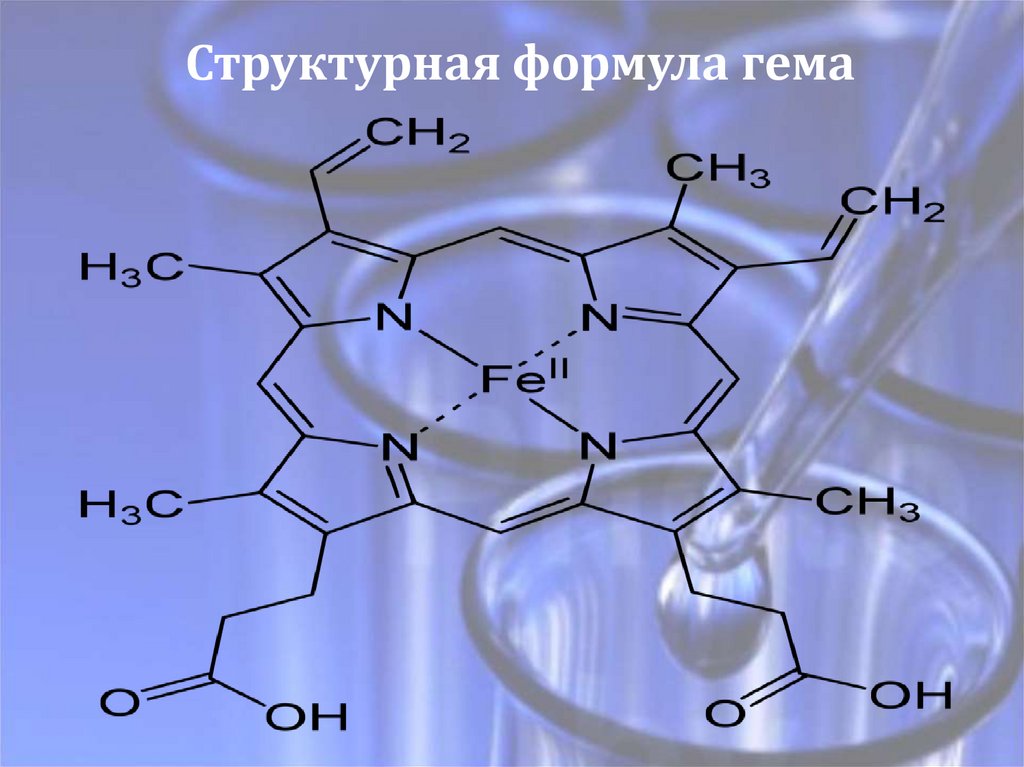
Структурная формула гема9.
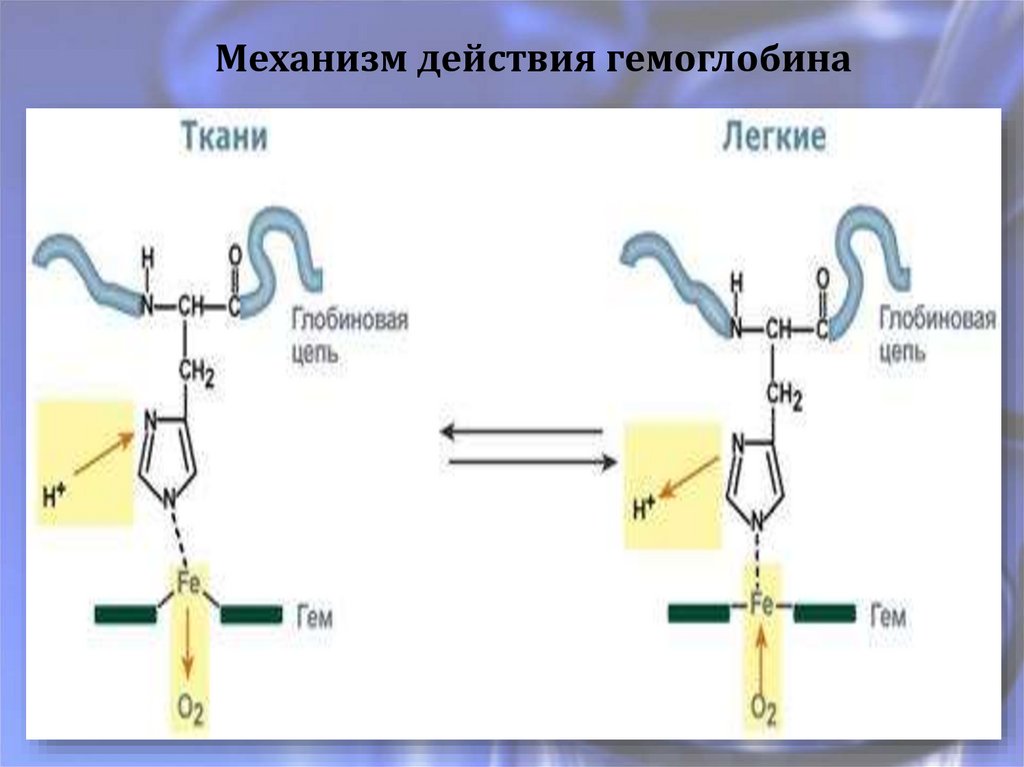
Механизм действия гемоглобина10.
Fe11.
Лабораторный практикумТехника безопасности при работе
с оборудованием и реактивами:
1. Проходы между рядами должны быть свободными.
2. Реактивы должны находиться на середине стола.
3. Без разрешения учителя ничего не трогать.
4. Не направлять пробирку в лицо себе или кому-либо.
5. Наливать в пробирку не более 1-2 мл реактива.
6. Перед тем, как наливать реактив, пробирку вынуть из штатива.
7. В конце урока сдать штатив с пробирками и реактивы учителю.
12.
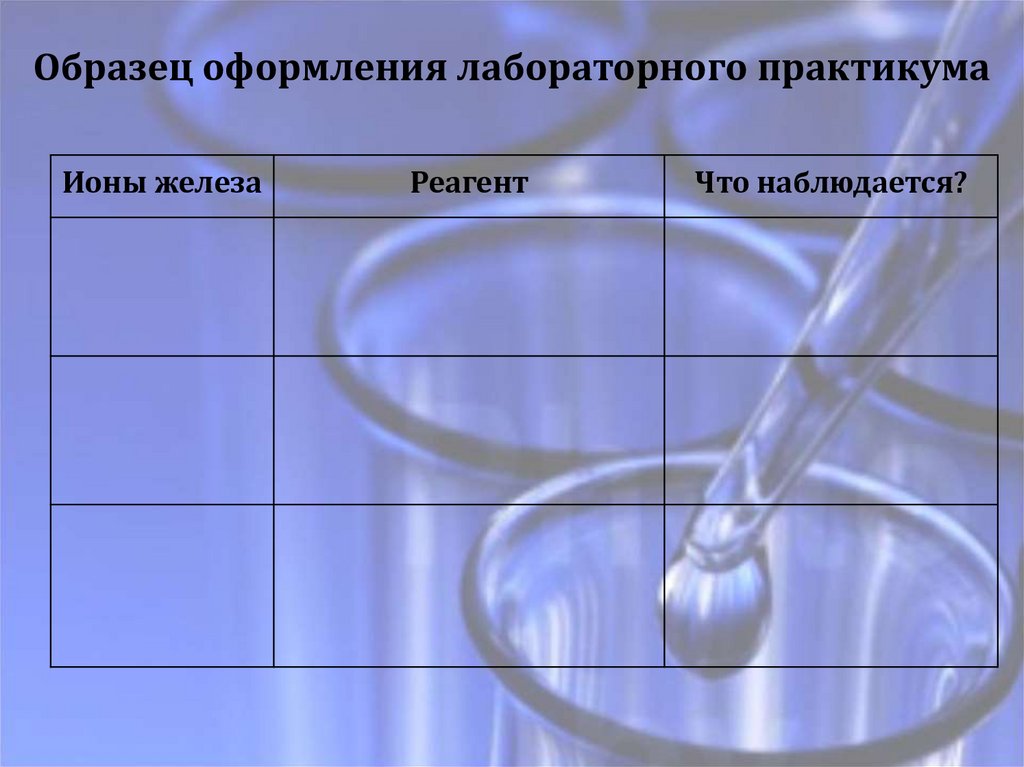
Образец оформления лабораторного практикумаИоны железа
Реагент
Что наблюдается?
13.
Проверка оформления лабораторного практикумаИоны железа
Реагент
Что наблюдается?
Fe2+
K3[Fe(CN)6]
красная кровяная соль
Синий осадок
турнбулева синь
Fe3+
K4[Fe(CN)6]
желтая кровяная соль
Синий осадок
берлинская лазурь
KSCN
роданид калия
Кроваво-красный
раствор
роданид железа
Fe3+
14.
Подведение итогов урока1) Зачем и с какой целью мы изучали этот материал?
2) Какую биологическую функцию выполняет железо?
3) Какие области применения железа вам известны?
4) Как называются химические реагенты, которые мы с
вами использовали для определения ионов железа?
15.
Домашнее заданиеУчебник О.С. Габриэлян
§17, стр. 119-124.
на стр. 123-124 выполнить задания №1-6












 Химия
Химия








