Похожие презентации:
Химический состав нефтей. Ненасыщенные углеводороды. Алкены и алкадиены
1. Химия нефти и газа
Лекция №5Химический состав нефтей.
Ненасыщенные углеводороды.
Алкены и алкадиены.
02.02.2019
2.
Алкенамиили
олефинами
называются
органические соединения, молекулы которых содержат
углеродные атомы, затрачивающие на соединение с
соседним
углеродным
атомом
две
валентности.
Остальные валентности насыщены атомами водорода.
Количество
водородных
атомов
в
молекулах
алкенов значительно меньше атомов водорода в
молекулах алканов, поэтому данный класс соединений
относится к ненасыщенным углеводородам.
Общая формула: CnH2n
2
02.02.2019
3.
I.Номенклатура и изомерия алкенов1.
Эмпирическая номенклатура (тривиальная)
C2H4 – этилен
C3H6 – пропилен
C4H8 – бутилен
C5H10 – амилен
3
02.02.2019
4.
2. Систематическая номенклатура (IUPAC)По
систематической
номенклатуре
выбираем
самую
длинную цепь, несущую двойную связь.
Цепь нумеруем со стороны, к которой ближе расположена
двойная связь, и называем углеводород соответствующей
длины, изменяя в названии алкана окончание –ан на –ен .
1
2
3
CH2 = C – CH3
|
CH3
1
2
3
4
CH3 – CH = CH – CH3
5
4
4
3
2 – метилпропен – 1
2
бутен – 2
1
CH3 – CH2 – C = CH – CH3
|
3 – метилпентен – 2
CH3
02.02.2019
5.
При наличии двух или трёх двойныхсвязей в молекуле углеводорода окончание ан в названии соответствующего алкана в
соответствии с числом двойных связей
заменяется на окончание -диен, -триен с
указанием положения каждой из этих связей:
5
02.02.2019
6.
CH2 = C = CH21
2
3
пропадиен
4
CH2 = C = CH – CH3
1
2
3
4
CH2 = CH – CH = CH2
1
2
3
бутадиен – 1,3
4
CH2 = C – CH = CH2
|
CH3
6
бутадиен – 1,2
2 – метилбутадиен – 1,3
02.02.2019
7.
В промышленных процессахнефтепереработки алкены получаются в
смеси с алканами. Свойства их заметно
различаются, что используется при
разделении и выделении
индивидуальных соединений
7
02.02.2019
8.
II. Химические свойства этиленовых углеводородовРеакции
присоединения
алкилирования
замещения
полимеризации
окисления
8
02.02.2019
9.
1.Реакции присоединения (расщепление π – связи)1) реакции гидрирования (восстановления):
Pt Pd Ni
CH2 = CH2
9
+
H2
CH3 – CH3
02.02.2019
10.
2) реакции галогенирования:Алкены
при
обычных условиях присоединяют
галоген, особенно легко хлор и бром. В результате
образуются дигалогенопроизводные алканов, содержащие
галогены у соседних атомов углерода.
CH2 = CH2
10
+
Cl2
CH2 – CH2
|
|
Cl
Cl
02.02.2019
11.
Реакция алкенов с бромом используется длякачественного обнаружения непредельных
соединений в нефтепродуктах, так как при этом
взаимодействии происходит обесцвечивание бурого
раствора брома
11
02.02.2019
12.
Качественная реакция на ненасыщенную связьCH2 = CH2
12
+
Br2
CH2 – CH2
|
|
Br
Br
02.02.2019
13.
14.
Хлорирование алкенов имеет большое значениев производстве пластмасс, каучуков, растворителей.
Хлорированием этилена получают растворитель дихлорэтан
Из дихлорэтана получают хлористый винил важный продукт для производства
полихлорвиниловых пластмасс:
0
CH2Cl
14
CH2Cl
480-520
CH2 CHCl
хлористый
винил
HCl
.
02.02.2019
15.
3) реакции гидратации:Катализаторы реакции – H2SO4, H3PO4, Al2O3
Реакция идет по правилу Марковникова:
H+
CH2 = CH – CH3
CH3 – CH – CH3
|
OH
Гидратацией алкенов – присоединением воды –
получают в промышленности одноатомные спирты:
этиловый, изопропиловый и другие.
Важнейшим из них является этиловый спирт,
который используется в качестве растворителя, в
производстве синтетического каучука, полимеров,
эфиров и т.д.
15
+
H2O
02.02.2019
16.
Этиловый, изопропиловый и другие спиртыиспользуют для вытеснения остаточной нефти.
Их добавляют к кислотам при кислотной
обработке скважин, что приводит к снижению
набухаемости глинистых пород. Это
способствует увеличению радиуса воздействия
кислотой на пласт, облегчению выноса
продуктов реакции из призабойной зоны и
увеличению эффективности кислотных
16
обработок.
02.02.2019
17.
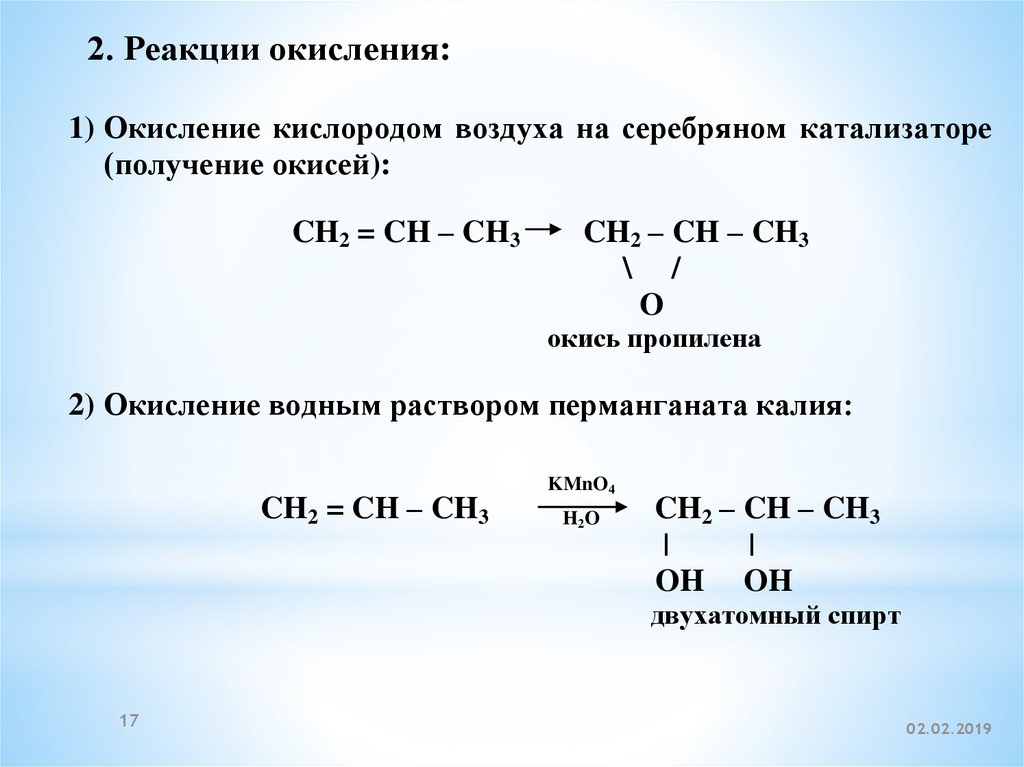
2. Реакции окисления:1) Окисление кислородом воздуха на серебряном катализаторе
(получение окисей):
CH2 = CH – CH3
CH2 – CH – CH3
\ /
O
окись пропилена
2) Окисление водным раствором перманганата калия:
CH2 = CH – CH3
KMnO4
H2O
CH2 – CH – CH3
|
|
OH OH
двухатомный спирт
17
02.02.2019
18.
19.
3) Окислениекалия
концентрированным
CH2 = CH – CH3
раствором
перманганата
KMnO4
H – C = O + CH3 – C = O
|
|
OH
OH
Образуются две кислоты
H2SO 4 (к)
Если имеются два заместителя при одном углеродном атоме, то
образуется кетон и кислота:
CH3 – C = CH – CH3
|
CH3
19
KMnO4
H2SO 4 (к)
CH3 – C = O + CH3 – C = O
|
|
CH3
OH
02.02.2019
20.
4) Озонирование (окисление озоном)Реакция Гарриеса
(используется для определения строения олефина):
CH2 = CH – CH3
O3
CH2 – O – CH – CH3
|
|
O –––––– O
изоозонид
(взрывоопасное соединение)
CH2 – O – CH – CH3 + H2O
|
|
O –––––– O
20
H – C = O + CH3 – C = O + H2O2
|
|
H
H
02.02.2019
21.
Озон количественно присоединяется к алкенампри комнатной температуре. При этом
ароматические углеводороды, находящиеся
вместе с алкенами в нефтепродукте,
практически не реагируют с озоном
На реакции озонирования алкенов основано
количественное определение алкенов в
нефтепродуктах.
21
02.02.2019
22.
3. Реакции полимеризации:Полимеризация – процесс образования высокомолекулярного вещества
(полимера) путём соединения молекул низкомолекулярного вещества
(мономера), протекающий без изменения химического состава и не
сопровождающийся образованием побочных продуктов
nCH2 = CH2
мономер
nCH2 = CH
|
CH3
–[ CH2 – CH2] n–
полимер
– CH2 – CH –
|
CH3 n
nCH3 – CH = CH – CH3
– CH – CH –
|
|
CH3 CH3 n
n – степень полимеризации,
степень полимеризации – число мономерных звеньев в молекуле полимера
или олигомера.
22
02.02.2019
23.
4. Реакция алкилирования:Катализаторы: H2SO4, H3PO4 (протонные кислоты)
+ –
CH3 – C = CH2 + H+
|
CH3
23
CH3 – C+ – CH3
|
CH3
CH3
|
CH3 – C+ – CH3 + CH3 – C = CH2
CH3 – C – CH2 – C+ – CH3
|
|
|
|
CH3
CH3
CH3
CH3
CH3
CH3
|
|
+
CH3 – C – CH2 – C – CH3 + CH3 – CH
|
|
|
CH3
CH3
CH3
CH3
CH3
|
|
CH3 – C – CH2 – CH – CH3 + CH3 – C+
|
|
|
CH3
CH3
CH3
моторное топливо
02.02.2019
24.
5. Реакции замещенияРяд устойчивости радикалов:
CH3
CH3
|
|
CH2 = CH – CH2 > CH3 – C• > CH3 – CH• > CH3 – CH2 – CH2 > CH3 > CH2 = CH
|
CH3
1) Галогенирование:
α
CH2 = CH – CH2 – CH3 + Cl2
24
300 - 350ºC
CH2 = CH – CH – CH3 + HCl
|
Cl
02.02.2019
25.
Алкадиены способны ко всем вышеперечисленнымреакциям, характерным для двойной связи.
Однако непредельные соединения с сопряжёнными
двойными связями обладают вследствие сопряжения
двойных и простых связей рядом специфических
особенностей. Это, в первую очередь, сказывается на
реакции присоединения.
При воздействии галогенов, водорода и других реагентов
на алкадиены с сопряжёнными связями происходит
присоединение к крайним атомам углерода, и в середине
молекулы возникает вместо одинарной двойная связь:
25
02.02.2019
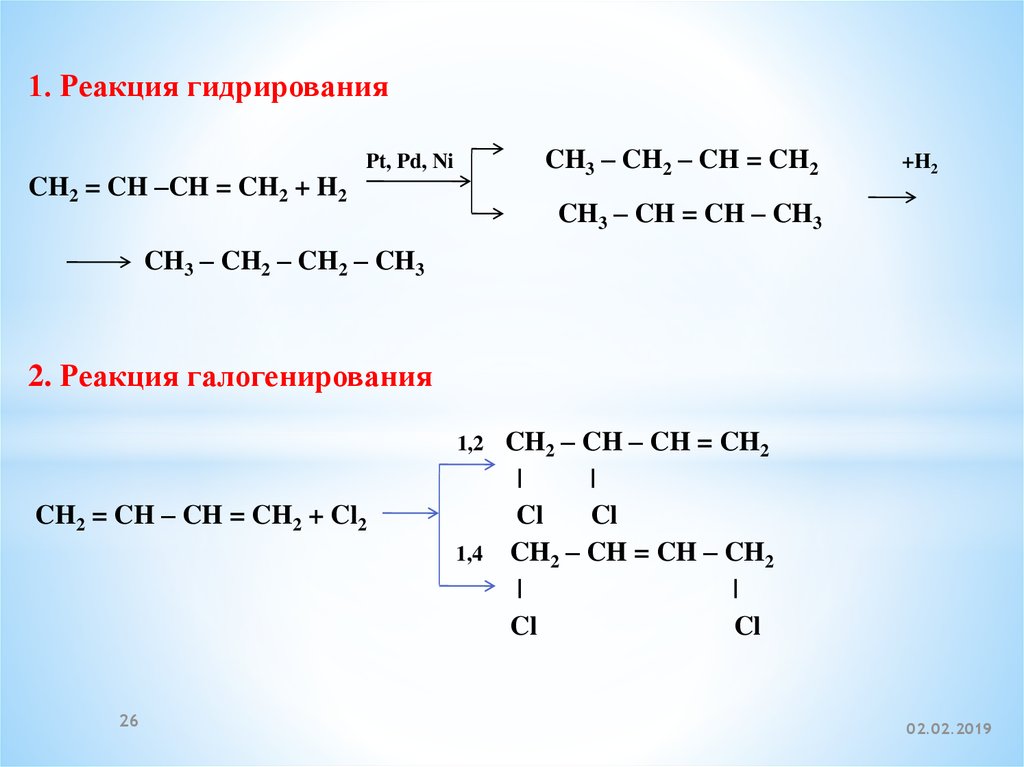
26.
1. Реакция гидрированияCH2 = CH –CH = CH2 + H2
CH3 – CH2 – CH = CH2
Pt, Pd, Ni
+H2
CH3 – CH = CH – CH3
CH3 – CH2 – CH2 – CH3
2. Реакция галогенирования
1,2
CH2 = CH – CH = CH2 + Cl2
1,4
26
CH2 – CH – CH = CH2
|
|
Cl
Cl
CH2 – CH = CH – CH2
|
|
Cl
Cl
02.02.2019
27.
Большое значение имеют реакцииприсоединения алкена к диену с
сопряжёнными двойными связями (реакции
диенового синтеза)
27
02.02.2019
28.
3. Реакции диенового синтеза:CH2 = CH – CH = CH2 + CH2 = CH2
Диенофилы:
алкены, алкины,
ненасыщенные карбоновые кислоты,
нитрилы ненасыщенных карбоновых кислот,
ангидриды ненасыщенных карбоновых кислот.
28
02.02.2019
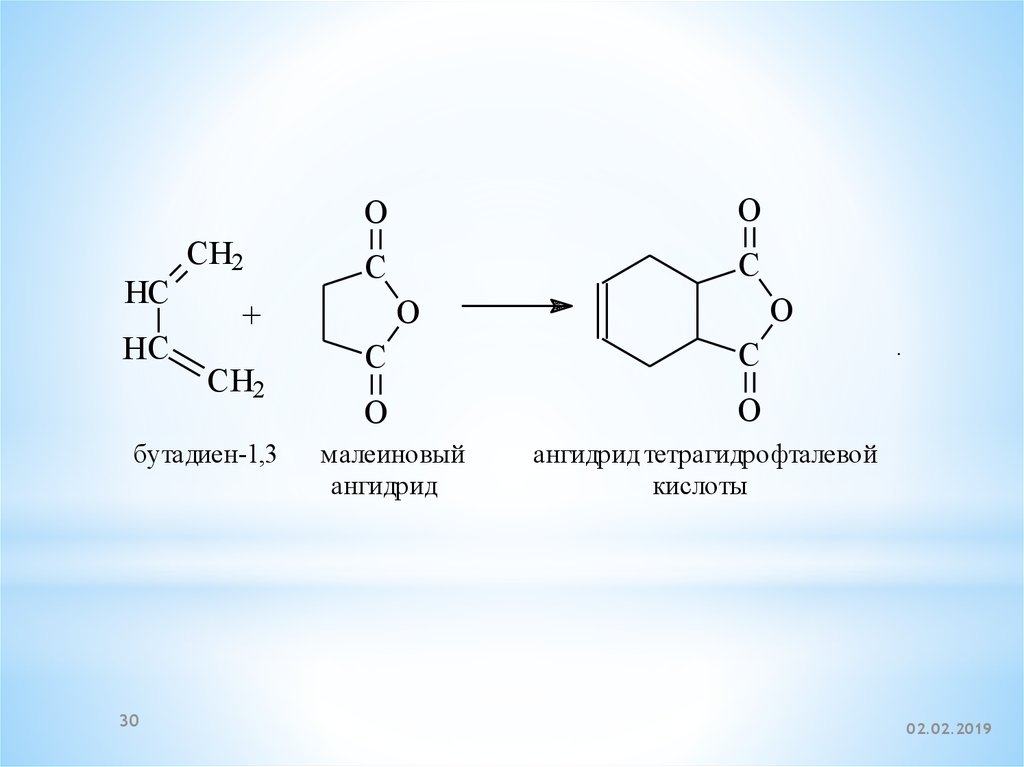
29.
Эта реакция лежит в основе образованияаренов при термической переработке
алканов. На реакции диенового синтеза
диенов с малеиновым ангидридом основано
отделение диенов и их количественное
определение в нефтепродуктах, поскольку
образующийся продукт представляет собой
кристаллическое вещество:
29
02.02.2019
30.
HCHC
CH2
O
C
C
CH2
O
O
+
бутадиен-1,3
30
O
C
C
O
O
малеиновый
ангидрид
.
ангидрид тетрагидрофталевой
кислоты
02.02.2019
31. Спасибо за Ваше внимание!
3102.02.2019
02.02.2019




























 Химия
Химия








