Похожие презентации:
Амины. Часть 2
1.
2.Реакции с электрофильнымиреагентами
•Амины из-за неподеленной электронной
пары N являются нуклеофилами. Поэтому
они способны реагировать с
электрофилами, такими как катионы
металлов с вакантными d-орбиталями,
кислотами Льюиса, а также различными
С-, О-, N-, галоген- и S-электрофилами.
2.
2.1) Взаимодействие аминов сС-электрофилами
К этому типу относятся реакции:
а) алкилирования аминов
галогеналканами, спиртами и т.д. (см.
способы получения аминов);
б) ацилирование аминов ангидридами и
галогенангидридами карбоновых
кислот;
в) реакции аминов с альдегидами и
кетонами;
г) реакция аминов с хлороформом в
щелочной среде
3.
• б) Реакция ацилирования аминогруппы ангидридами и галогенангидридами карбоновых кислотприводит к получению N-ациламинов,
которые
называются
амидами карбоновых кислот
• Ацилируются только первичные
и вторичные амины
4.
OR
-HCl
C
H2N
Cl
хлорангидрид
кислоты
O
R
C
O
ангидрид
кислоты
R
R'
амин
C
HN R'
амиД
карбоновой
кислоты
-RCOOH
H2N
C
R'
амин
O
R
O
O
R
C
HN
N-алкил амиД
R'
карбоновой
кислоты
5.
• в) в реакциях с альдегидами иликетонами амины выступают в роли
нуклеофильных реагентов и
образуются альдимины или кетимины
O
R
C
H
альдегид
(кетон)
H2N R'
амин
-H2O
R
C N R'
H
альдИМИН
(кетимин)
6.
• г) реакция с хлороформом СНCl3 вщелочной среде является качественной
на первичные амины, т.к. в результате
реакции образуются изонитрилы (имеют
крайне неприятный запах). Реакция
называется изонитрильная проба
R
NH2
CHCl3 + NaOH
первичный
амин
R N C + NaCl + H2O
изонитрил
7. 2.2) Взаимодействие аминов с N-элект-рофилами (c азотистой кислотой)
2.2) Взаимодействие аминов с N-электрофилами (c азотистой кислотой)• Реакция позволяет различить между
собой первичные, вторичные и
третичные амины, т.к. образуются
различные продукты.
• НNO2 – вещество неустойчивое и
образуется
непосредственно
в
процессе реакции
NaNO2 + HCl
o
0-5 C
HNO2 + NaCl
8.
• а) Реакция первичных алифатическихаминов с НNO2
• Наблюдается моментальное
выделение газа («закипание смеси»)
C4H9 NH2
бутиламин
NaNO2
HCl
0 - 5oC
C4H9 OH + NaCl + N2
бутан-1-ол
9.
• б) Реакция первичных ароматическихаминов с НNO2
NH2
NaNO2
HCl
N N Cl
0 - 5oC
соль диазония
t > 15o C
H2O
N N Cl
OH + N2
фенол
OH
N N
- нафтол
HO
азокраситель
10.
Т> 10-15oCβ-Нафтол
Соль
диазония
(прозрачный р-р)
11.
• г) Реакция вторичных аминов с НNO2• Образуется нерастворимая в воде
тяжелая маслянистая жидкость или
осадок желтого цвета
R NH R1
NaNO2
HCl
o
0-5 C
R N R1
+ H2O
N=O
N- нитрозодиалкиламин
12.
• д) Реакция третичных аминов с НNO2• Третичные алифатические амины с
НNO2 не взаимодействуют. Исключение
составляют смешанные диалкилариламины.
• Идет
реакция
нитрозирования
по
бензольному кольцу с образованием
осадка
соли
нитрозопроизводного
желтого цвета, которая при изменении
рН > 8 окрашивается в зеленый цвет
13.
CH3N
CH3
NaNO2
HCl
CH3
O=N
NH
0 - 5oC
CH3
Cl
CH3
NaHCO3
O=N
+ NaCl + CO2 + H2O
N
CH3
4-нитрозо- N,N -диметиланилин
14.
NaHCO315.
2.3) Реакции сО-электрофилами
• К ним относятся реакции
• - с перекисью водорода
• - с кислородом
16.
HR
NH + H2O2
R
R
N
O
R
N-оксид
амина
R
N
OH
R
диалкилгидроксиламин
17.
• Третичные амины ведут к получениюN-оксидов аминов
R
R
N + H2O2
R
R
R
N
O
R
N-оксид
амина
18.
Химические свойстваариламинов
Определяются наличием электронной
пары на N, полярностью связей С-N и
N-H, а также влиянием аминогруппы на
ароматическое кольцо.
Реакции с электрофильными
реагентами могут идти как по
аминогруппе, так и по ароматическому
кольцу, т.к присутствие аминогруппы
(+M >> -I, ЭД) значительно активирует
ароматический цикл к реакциям SE (о- и
п-положения).
19.
1) Реакции с С-электрофилами
Алкилирование ароматических
аминов галогеналкилами и спиртами
протекает по аминогруппе
NH2 + 2 CH3I
NaOH
- NaI
анилин
N,N-диметиланилин
NH2 + 2 CH3OH
анилин
N
t0C
- HOH
N
N,N-диметиланилин
20.
• Взаимодействие с альдегидами и кетонамидает ароматические имины - основания Шиффа
N C
NH2
реагент
R
R1
O
+ R C R1
+ H2O
субстрат
диалкилкетимин
O
C H
H2N
+
бензальдегид
CH N
H2O
анилин
бензальанилин
21.
Реакции ацилирования идут строго по атому азота,а не бензольному кольцу
NH2
O -HCl
H3C
Cl
хлорангидрид
уксусной кислоты
H3C
H
CO
O
C
O
ангидрид
уксусной
кислоты
H3
C
O
анилин
ацетанилид
O
NH2
H3C
CH3
C
-C
анилин
O
HN C
22.
2) Реакции с N-электрофиламиРеакции ароматических аминов с HNO2 в
зависимости от строения амина дают
разные продукты и используется как
качественная.
23.
а) Первичные ароматические амины сHNO2 образуют соли диазония (реакция
называется диазотированием)
NH2
NaNO2, HX
0-50C
-NaX, HOH
R
первичный
ароматический
амин
N
N
X
R
ариладиазоний
галогенид или
гидросульфат
Реакция будет подробно изучена ниже.
24.
б) Вторичные ароматические аминытакже как и алифатические в данной
реакции образуют N-нитрозамины
Ar
NH
R'
NaNO2, HX
0-50C
-NaCl, HOH
вторичный
ароматический
амин
Ar
N
N
O
R'
N-нитрозамин
осадок
желтого цвета
25.
3) Реакции с галогенамиРеакции с Cl2 и Br2 идут очень легко по
всем трем положениям (орто- и пара-)
ароматического цикла, не требует
катализатора (к-ты Льюиса). Реакция с
раствором Br2 является качественной на
любые ароматические амины.
Внешний признак: вначале
обесцвечивание бромного раствора, при
3-х кратном избытке реагента – выпадение
светлого осадка
26.
BrNH2
3 Br2
H 2O
Br
NH2
+ 3 HBr
Br
Br
CH3
NH2
2 Br2
H 2O
CH3
NH2
Br
+ 2 HBr
27.
28.
Для получениямонобромпроизводных
необходимо снизить активность
аминогруппы, переведя ее в
ацетамидную
NH2
сильный ЭД
CH3
O
C Cl
O
NH C CH3
ЭД средней силы
29. Монобромирование
NHCOCH3NHCOCH3
H2O,HCl,to C
CH3COOH
Br2,CH3COOH
HBr
Cl
Br
Br
N(CH3)2
NH2
NH3
N(CH3)2
Br2, CH3COOH
HBr
Br
NaOH
NaCl
Br
30.
• Для получения мета-производных аминыпереводят в соли. При этом снижается
активность и изменяется ориентирующее влияние заместителя
NH2
HCl
NH3 Cl
сильный ЭД
сильный ЭA
NH2
NH3 Cl
Br2
FeBr3
HBr
Br
NH3 Cl
NaOH
NaCl
H2O
Br
31.
В отличие от бензола и его гомологов, анилин идругие ароматические амины могут быть
подвергнуты прямому иодированию в кольцо.
Реакция анилина с I2 протекает в воде в гетерогенной
среде. Для связывания выделяющейся
иодистоводородной кислоты используют соду.
32.
4)Реакция с S- электрофиламиСульфирование анилина H2SO4 ведёт к
гидросульфату анилиния, который при
нагревании до 2000С изомеризуется в 4аминобензолсульфокислоту
NH2
NH3 HSO4
+ H2SO4
анилин
NH2
2000C
анилиний
гидросульфат
SO3H
33.
Защита аминогруппы ароматическихаминов при проведении SE реакций
Необходимость защиты аминогруппы
возникает при проведении реакций
нитрования, ацилирования, алкилирования, сульфохлорирования
Защита достигается
• 1 – превращением NH2-группы в Nациламиногруппу (ацильная защита);
• 2 – протонирование -NH2 с образованием
группы -NH3+, не склонной к окислению и
взаимодействию с электрофильными
реагентами.
34.
• При 1-ом способе защитыосуществляется реакция первичного
ароматического амина с ацилирующим
средством (ангидридом или
галогенангидридом карбоновой кислоты)
с получением N- ациламина. При этом
не изменяется ориентирующее
влияние заместителя на направление
следующих SE реакций, в то время как
реакции электрофильных реагентов по
аминогруппе и ее протонирование
исключаются.
35. Нитрование ароматических аминов
Амины, в том числе и ароматические,весьма чувствительны к окислению, а
азотная кислота является сильным
окислителем, поэтому прямое нитрование
анилина с участием азотной кислоты
осуществить невозможно.
В этом случае необходимо использовать
защиту аминогруппы.
Для получения орто- и пара-нитроанилинов используют «Ацильную защиту».
36.
NH2NH2
-I < +M,
ЭД, I рода
HNO3, к.
H2SO4, к.
анилин
-HCl
R
NO2
O
4-нитроанилин
C
Cl
O
HN
C
-I < +M,
ЭД, I рода
R
HNO3, к.
ацетнилид
H2SO4, к.
- о-изомер
- HOH
O
HN
C
R
HOH
-RCOOH
NO2
4-нитроацетнилид
37.
При нитровании ацетанилида нитрующейсмесью с последующим гидролизом
образуется смесь в соотношении (10%)
орто-изомера и (90%)пара-изомера.
Нитрование ацетанилида смесью азотной
кислоты с уксусным ангидридом приводит к
обратному соотношению изомеров —
орто-изомера образуется 70%.
38.
Ацильную защиту аминогруппыиспользуют также для проведения
реакций моногалогенирования (см.
выше), алкилирования и
ацилирования бензольного цикла в
орто- и пара-положения
39.
NH2(CH3CO)2O
O
O
NH C CH3
NH C CH3
CH3Br
CH3COOH
NH2
BF3
CH3
+ CH3COONa
CH3
NaOH
40.
• 2-ой способ защитыаминогруппы (перевод в
аммонийную соль)
• – при протонировании аминогруппы
ориентация реакций SE изменяется, т.к.
заместитель -NH3+ (-I эффект) является
электроноакцепторным, направляющим
реакцию в мета-положение.
41.
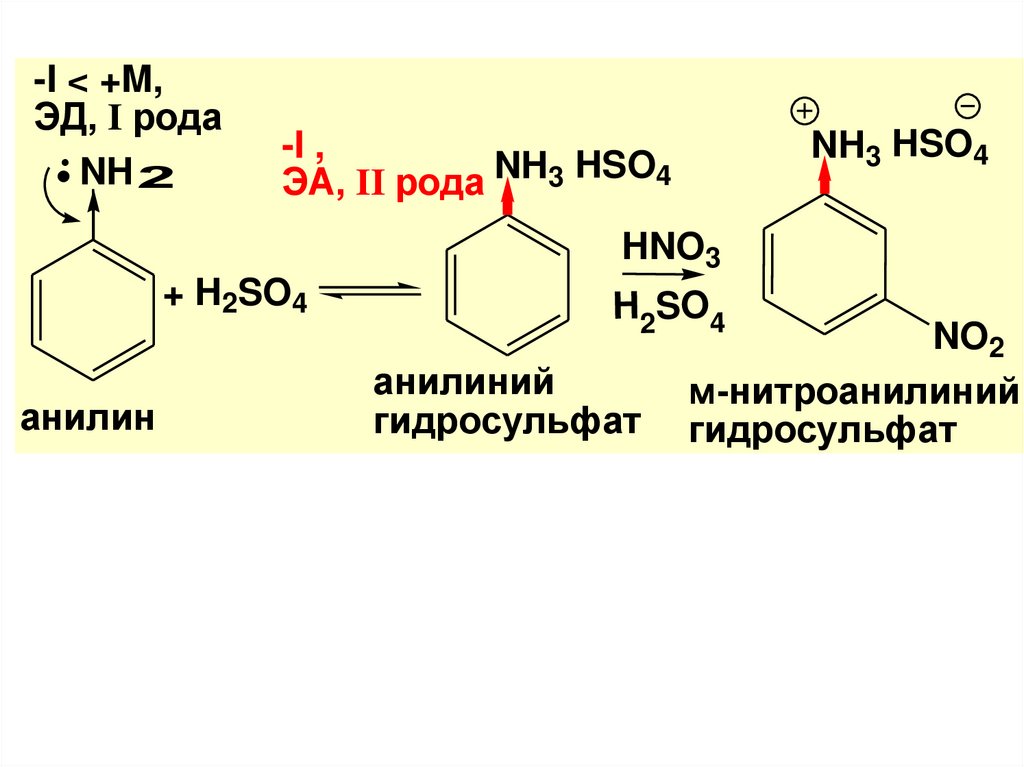
-I < +M,ЭД, I рода
NH 2
NH3 HSO4
-I ,
ЭA, II рода NH3 HSO4
HNO3
+ H2SO4
анилин
H2SO4
анилиний
гидросульфат
NO2
м-нитроанилиний
гидросульфат
42.
• Далее соль обрабатывают щелочьюдля выделения свободного амина
NH3 HSO4
+ NaOH
NO2
NH2
+ NaHSO4 + H2O
NO2
мета-нитроанилин
Этот способ нельзя использовать для
проведения реакций ацилирования и
алкилирования, так как группа NH3+
сильный ЭА
43.
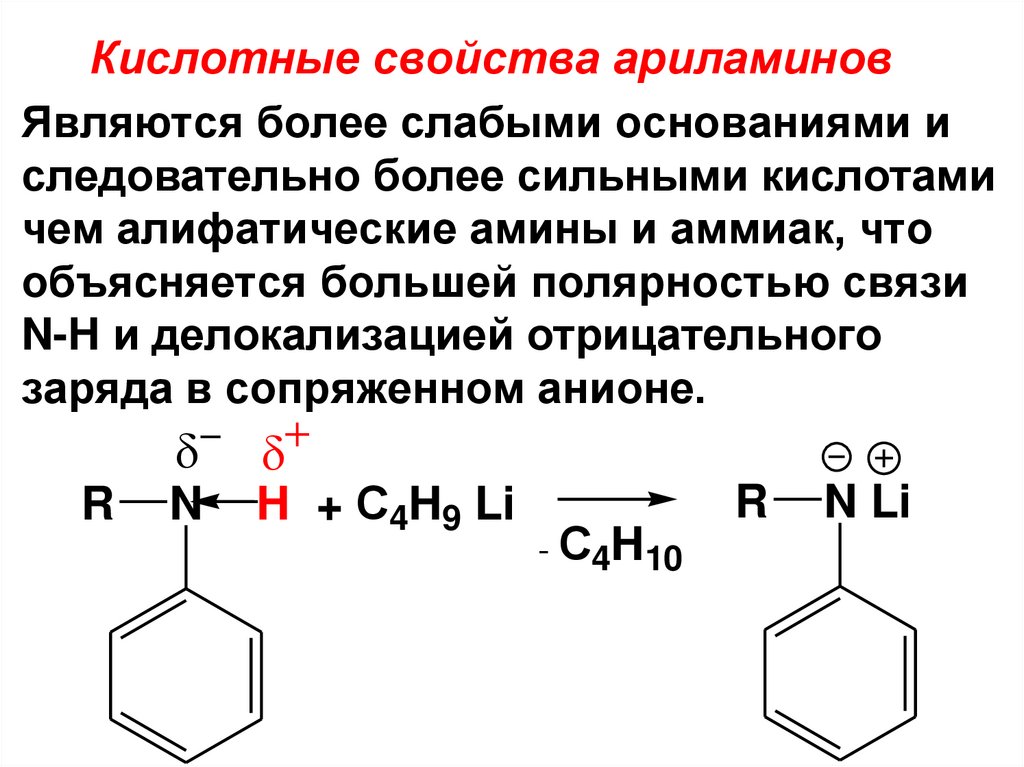
Кислотные свойства ариламинов• Являются более слабыми основаниями и
следовательно более сильными кислотами
чем алифатические амины и аммиак, что
объясняется большей полярностью связи
N-H и делокализацией отрицательного
заряда в сопряженном анионе.
R
N
H + С4H9 Li
- С4H10
R
N Li
44. Окисление аминов
Амины весьма лабильны по отношению к окислителям. Направление реакции существенным образомзависит как от структуры исходного амина, так и от
природы окислителя.
А) Окисление перманганатом и дихроматом
калия. Перманганат калия окисляет первичные
амины в нитросоединения. Эта реакция идет с
высоким выходом только в том случае, когда
аминогруппа находится у третичного атома углерода.
45.
При окислении анилина KMnO4 или K2Cr2O7 внейтральной среде конечным продуктом
является пара-бензохинон. Реакция протекает
через образование ряда промежуточных
продуктов окисления:
46.
Окисление анилина перманганатом илибихроматом калия в кислой среде приводит
к сложной смеси продуктов. Главным
образом в этих условиях образуется
краситель «анилиновый черный»,
представляющий собой смесь полимерных
продуктов, не установленной до конца
структуры.
47.
А) Окисление пероксикислотами.при окислении анилина карбоновыми
надкислотами (RCOOOH) может быть
получен нитрозобензол и далее —
нитробензол.
48. Применение аминов
• 1. Для производства лекарственныхпрепаратов (сульфаниламидные и др.)
• 2. Для производства красителей
• 3. В производстве полимерных
материалов (каучуков, полиуретанов,
полиамидов, найлона, капрона и др.)
• 4. Пестициды – средства защиты
растений
• 5. ПАВ, ингибиторы коррозии,
фотоматериалы и др.














































 Химия
Химия








